醫(yī)藥網(wǎng)12月28日訊 13個(gè)首仿藥,,預(yù)計(jì)明年上市!
據(jù)Insight數(shù)據(jù)庫(kù)篩選,,恒瑞,、正大天晴、東陽(yáng)光藥業(yè),、長(zhǎng)春海悅,、科倫藥業(yè)、豪森藥業(yè),、石藥歐意,、南京先聲東元,,這些企業(yè)的13個(gè)首仿藥品預(yù)計(jì)會(huì)在2019年上市。如下圖:
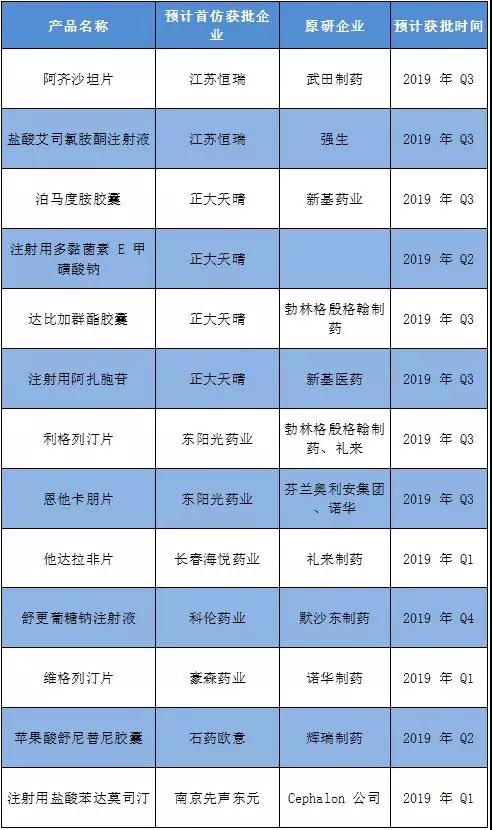 ▍藥品審評(píng)審批加速
近年來(lái),,藥品審評(píng)審批逐步進(jìn)入快車道,。
2015年,國(guó)務(wù)院印發(fā)《關(guān)于改革藥品醫(yī)療器械審評(píng)審批制度的意見》,,2017年,,中辦國(guó)辦印發(fā)《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見》(以下簡(jiǎn)稱42號(hào)文件),極大地推動(dòng)了藥品醫(yī)療器械審評(píng)審批制度改革,。
隨后,,圍繞落實(shí)44號(hào)、42號(hào)文件要求,,藥監(jiān)系統(tǒng)研究制定藥品審評(píng)審批制度改革相關(guān)配套政策文件,,或征求意見稿203件,其中與44號(hào)文件相關(guān)的配套文件91件,,與42號(hào)文件相關(guān)的配套文件102件,,為深化藥品、醫(yī)療器械審評(píng)審批改革提供了制度保障,。
▍2019年,,或有更多藥品獲批上市
截至2018年10月,新藥好藥上市加快,,我國(guó)自主研發(fā)的83個(gè)新藥165件申請(qǐng),,已通過(guò)優(yōu)先審評(píng)程序批準(zhǔn)上市;排隊(duì)等待審評(píng)的藥品注冊(cè)申請(qǐng)已由2015年高峰時(shí)的近2.2萬(wàn)件降至3000件以下,。
國(guó)家藥監(jiān)局表示,,下一步要加快進(jìn)口藥上市步伐,加快臨床急需藥品審評(píng)審批,,促進(jìn)境外已上市新藥盡快在境內(nèi)上市,;對(duì)在境外還沒上市的創(chuàng)新藥,也要力爭(zhēng)做到境內(nèi)外同步上市,。
由此可見,,上述Insight 數(shù)據(jù)庫(kù)篩選出來(lái)的13個(gè)首仿藥品,很可能并不是全部,,在藥品審評(píng)審批加速的前提下,,有可能明年會(huì)有更多的新藥、仿制藥獲批上市,。
▍藥品審評(píng)審批加速
近年來(lái),,藥品審評(píng)審批逐步進(jìn)入快車道,。
2015年,國(guó)務(wù)院印發(fā)《關(guān)于改革藥品醫(yī)療器械審評(píng)審批制度的意見》,,2017年,,中辦國(guó)辦印發(fā)《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見》(以下簡(jiǎn)稱42號(hào)文件),極大地推動(dòng)了藥品醫(yī)療器械審評(píng)審批制度改革,。
隨后,,圍繞落實(shí)44號(hào)、42號(hào)文件要求,,藥監(jiān)系統(tǒng)研究制定藥品審評(píng)審批制度改革相關(guān)配套政策文件,,或征求意見稿203件,其中與44號(hào)文件相關(guān)的配套文件91件,,與42號(hào)文件相關(guān)的配套文件102件,,為深化藥品、醫(yī)療器械審評(píng)審批改革提供了制度保障,。
▍2019年,,或有更多藥品獲批上市
截至2018年10月,新藥好藥上市加快,,我國(guó)自主研發(fā)的83個(gè)新藥165件申請(qǐng),,已通過(guò)優(yōu)先審評(píng)程序批準(zhǔn)上市;排隊(duì)等待審評(píng)的藥品注冊(cè)申請(qǐng)已由2015年高峰時(shí)的近2.2萬(wàn)件降至3000件以下,。
國(guó)家藥監(jiān)局表示,,下一步要加快進(jìn)口藥上市步伐,加快臨床急需藥品審評(píng)審批,,促進(jìn)境外已上市新藥盡快在境內(nèi)上市,;對(duì)在境外還沒上市的創(chuàng)新藥,也要力爭(zhēng)做到境內(nèi)外同步上市,。
由此可見,,上述Insight 數(shù)據(jù)庫(kù)篩選出來(lái)的13個(gè)首仿藥品,很可能并不是全部,,在藥品審評(píng)審批加速的前提下,,有可能明年會(huì)有更多的新藥、仿制藥獲批上市,。
 ▍藥品審評(píng)審批加速
近年來(lái),,藥品審評(píng)審批逐步進(jìn)入快車道,。
2015年,國(guó)務(wù)院印發(fā)《關(guān)于改革藥品醫(yī)療器械審評(píng)審批制度的意見》,,2017年,,中辦國(guó)辦印發(fā)《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見》(以下簡(jiǎn)稱42號(hào)文件),極大地推動(dòng)了藥品醫(yī)療器械審評(píng)審批制度改革,。
隨后,,圍繞落實(shí)44號(hào)、42號(hào)文件要求,,藥監(jiān)系統(tǒng)研究制定藥品審評(píng)審批制度改革相關(guān)配套政策文件,,或征求意見稿203件,其中與44號(hào)文件相關(guān)的配套文件91件,,與42號(hào)文件相關(guān)的配套文件102件,,為深化藥品、醫(yī)療器械審評(píng)審批改革提供了制度保障,。
▍2019年,,或有更多藥品獲批上市
截至2018年10月,新藥好藥上市加快,,我國(guó)自主研發(fā)的83個(gè)新藥165件申請(qǐng),,已通過(guò)優(yōu)先審評(píng)程序批準(zhǔn)上市;排隊(duì)等待審評(píng)的藥品注冊(cè)申請(qǐng)已由2015年高峰時(shí)的近2.2萬(wàn)件降至3000件以下,。
國(guó)家藥監(jiān)局表示,,下一步要加快進(jìn)口藥上市步伐,加快臨床急需藥品審評(píng)審批,,促進(jìn)境外已上市新藥盡快在境內(nèi)上市,;對(duì)在境外還沒上市的創(chuàng)新藥,也要力爭(zhēng)做到境內(nèi)外同步上市,。
由此可見,,上述Insight 數(shù)據(jù)庫(kù)篩選出來(lái)的13個(gè)首仿藥品,很可能并不是全部,,在藥品審評(píng)審批加速的前提下,,有可能明年會(huì)有更多的新藥、仿制藥獲批上市,。
▍藥品審評(píng)審批加速
近年來(lái),,藥品審評(píng)審批逐步進(jìn)入快車道,。
2015年,國(guó)務(wù)院印發(fā)《關(guān)于改革藥品醫(yī)療器械審評(píng)審批制度的意見》,,2017年,,中辦國(guó)辦印發(fā)《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見》(以下簡(jiǎn)稱42號(hào)文件),極大地推動(dòng)了藥品醫(yī)療器械審評(píng)審批制度改革,。
隨后,,圍繞落實(shí)44號(hào)、42號(hào)文件要求,,藥監(jiān)系統(tǒng)研究制定藥品審評(píng)審批制度改革相關(guān)配套政策文件,,或征求意見稿203件,其中與44號(hào)文件相關(guān)的配套文件91件,,與42號(hào)文件相關(guān)的配套文件102件,,為深化藥品、醫(yī)療器械審評(píng)審批改革提供了制度保障,。
▍2019年,,或有更多藥品獲批上市
截至2018年10月,新藥好藥上市加快,,我國(guó)自主研發(fā)的83個(gè)新藥165件申請(qǐng),,已通過(guò)優(yōu)先審評(píng)程序批準(zhǔn)上市;排隊(duì)等待審評(píng)的藥品注冊(cè)申請(qǐng)已由2015年高峰時(shí)的近2.2萬(wàn)件降至3000件以下,。
國(guó)家藥監(jiān)局表示,,下一步要加快進(jìn)口藥上市步伐,加快臨床急需藥品審評(píng)審批,,促進(jìn)境外已上市新藥盡快在境內(nèi)上市,;對(duì)在境外還沒上市的創(chuàng)新藥,也要力爭(zhēng)做到境內(nèi)外同步上市,。
由此可見,,上述Insight 數(shù)據(jù)庫(kù)篩選出來(lái)的13個(gè)首仿藥品,很可能并不是全部,,在藥品審評(píng)審批加速的前提下,,有可能明年會(huì)有更多的新藥、仿制藥獲批上市,。







