醫(yī)藥網(wǎng)8月18日訊 8月15日,片仔癀發(fā)布公告稱,1類新藥PZH2109膠囊申報臨床獲得CDE受理,,該藥品主要用于治療非酒精性脂肪性肝炎,,美國和中國暫無相同靶點相同適應癥的藥品獲批上市。 圖1:片仔癀1類新藥的申報情況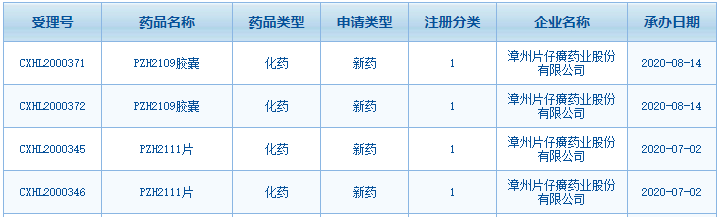 來源:CDE官網(wǎng) 片仔癀憑借三大獨家中成藥片仔癀,、片仔癀膠囊,、茵膽平肝膠囊稱霸肝炎中成藥零售市場,近年來公司在研發(fā)上瞄準了化藥市場,,2020年7月1類新藥PZH2111片申報臨床獲得受理,,該產(chǎn)品主要用于治療肝內(nèi)膽管細胞癌、尿路上皮細胞癌等晚期實體腫瘤,,國內(nèi)暫無相同適應癥的同類藥品獲批上市,,米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫數(shù)據(jù)顯示,目前兩個受理號均在審評審批中,。 近日,,該公司的1類新藥PZH2109膠囊申報臨床獲得CDE受理,該藥品主要用于治療非酒精性脂肪性肝炎(NASH),。公司已經(jīng)完成PZH2109膠囊原料藥以及制劑的藥學,、藥理毒理、非臨床安全性評價等方面的研究,,研究結(jié)果表明PZH2109膠囊具有良好的安全性,、成藥性及臨床開發(fā)價值。截至目前,,該藥品項目的研發(fā)投入累計約2,500萬元,。 據(jù)悉,2020年3月saroglitazar magnesium藥物治療NASH獲得印度藥物管理局(DCGI)批準上市,,美國和中國暫無與本項目相同靶點相同適應癥的藥品獲批上市,。資料顯示,,saroglitazar magnesium一種新型的過氧化物酶體增殖物活化受體(PPAR)激動劑,,該產(chǎn)品是世界上第一款獲批治療非肝硬化性NASH的藥物。 據(jù)公司年報數(shù)據(jù)顯示,,2019年片仔癀研發(fā)投入接近1.2億元,,同比增長18.47%,在研藥品品種11個,,涉及中藥,、化藥創(chuàng)新藥及仿制藥,除了PZH2111,、PZH2109外,,治療廣泛性焦慮癥新藥PZH1204也值得期待。 來源:CDE官網(wǎng)、米內(nèi)網(wǎng)數(shù)據(jù)庫 審評數(shù)據(jù)統(tǒng)計截至2020年8月17日,,如有錯漏,,敬請指正。
來源:CDE官網(wǎng) 片仔癀憑借三大獨家中成藥片仔癀,、片仔癀膠囊,、茵膽平肝膠囊稱霸肝炎中成藥零售市場,近年來公司在研發(fā)上瞄準了化藥市場,,2020年7月1類新藥PZH2111片申報臨床獲得受理,,該產(chǎn)品主要用于治療肝內(nèi)膽管細胞癌、尿路上皮細胞癌等晚期實體腫瘤,,國內(nèi)暫無相同適應癥的同類藥品獲批上市,,米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫數(shù)據(jù)顯示,目前兩個受理號均在審評審批中,。 近日,,該公司的1類新藥PZH2109膠囊申報臨床獲得CDE受理,該藥品主要用于治療非酒精性脂肪性肝炎(NASH),。公司已經(jīng)完成PZH2109膠囊原料藥以及制劑的藥學,、藥理毒理、非臨床安全性評價等方面的研究,,研究結(jié)果表明PZH2109膠囊具有良好的安全性,、成藥性及臨床開發(fā)價值。截至目前,,該藥品項目的研發(fā)投入累計約2,500萬元,。 據(jù)悉,2020年3月saroglitazar magnesium藥物治療NASH獲得印度藥物管理局(DCGI)批準上市,,美國和中國暫無與本項目相同靶點相同適應癥的藥品獲批上市,。資料顯示,,saroglitazar magnesium一種新型的過氧化物酶體增殖物活化受體(PPAR)激動劑,,該產(chǎn)品是世界上第一款獲批治療非肝硬化性NASH的藥物。 據(jù)公司年報數(shù)據(jù)顯示,,2019年片仔癀研發(fā)投入接近1.2億元,,同比增長18.47%,在研藥品品種11個,,涉及中藥,、化藥創(chuàng)新藥及仿制藥,除了PZH2111,、PZH2109外,,治療廣泛性焦慮癥新藥PZH1204也值得期待。 來源:CDE官網(wǎng)、米內(nèi)網(wǎng)數(shù)據(jù)庫 審評數(shù)據(jù)統(tǒng)計截至2020年8月17日,,如有錯漏,,敬請指正。
 來源:CDE官網(wǎng) 片仔癀憑借三大獨家中成藥片仔癀,、片仔癀膠囊,、茵膽平肝膠囊稱霸肝炎中成藥零售市場,近年來公司在研發(fā)上瞄準了化藥市場,,2020年7月1類新藥PZH2111片申報臨床獲得受理,,該產(chǎn)品主要用于治療肝內(nèi)膽管細胞癌、尿路上皮細胞癌等晚期實體腫瘤,,國內(nèi)暫無相同適應癥的同類藥品獲批上市,,米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫數(shù)據(jù)顯示,目前兩個受理號均在審評審批中,。 近日,,該公司的1類新藥PZH2109膠囊申報臨床獲得CDE受理,該藥品主要用于治療非酒精性脂肪性肝炎(NASH),。公司已經(jīng)完成PZH2109膠囊原料藥以及制劑的藥學,、藥理毒理、非臨床安全性評價等方面的研究,,研究結(jié)果表明PZH2109膠囊具有良好的安全性,、成藥性及臨床開發(fā)價值。截至目前,,該藥品項目的研發(fā)投入累計約2,500萬元,。 據(jù)悉,2020年3月saroglitazar magnesium藥物治療NASH獲得印度藥物管理局(DCGI)批準上市,,美國和中國暫無與本項目相同靶點相同適應癥的藥品獲批上市,。資料顯示,,saroglitazar magnesium一種新型的過氧化物酶體增殖物活化受體(PPAR)激動劑,,該產(chǎn)品是世界上第一款獲批治療非肝硬化性NASH的藥物。 據(jù)公司年報數(shù)據(jù)顯示,,2019年片仔癀研發(fā)投入接近1.2億元,,同比增長18.47%,在研藥品品種11個,,涉及中藥,、化藥創(chuàng)新藥及仿制藥,除了PZH2111,、PZH2109外,,治療廣泛性焦慮癥新藥PZH1204也值得期待。 來源:CDE官網(wǎng)、米內(nèi)網(wǎng)數(shù)據(jù)庫 審評數(shù)據(jù)統(tǒng)計截至2020年8月17日,,如有錯漏,,敬請指正。
來源:CDE官網(wǎng) 片仔癀憑借三大獨家中成藥片仔癀,、片仔癀膠囊,、茵膽平肝膠囊稱霸肝炎中成藥零售市場,近年來公司在研發(fā)上瞄準了化藥市場,,2020年7月1類新藥PZH2111片申報臨床獲得受理,,該產(chǎn)品主要用于治療肝內(nèi)膽管細胞癌、尿路上皮細胞癌等晚期實體腫瘤,,國內(nèi)暫無相同適應癥的同類藥品獲批上市,,米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫數(shù)據(jù)顯示,目前兩個受理號均在審評審批中,。 近日,,該公司的1類新藥PZH2109膠囊申報臨床獲得CDE受理,該藥品主要用于治療非酒精性脂肪性肝炎(NASH),。公司已經(jīng)完成PZH2109膠囊原料藥以及制劑的藥學,、藥理毒理、非臨床安全性評價等方面的研究,,研究結(jié)果表明PZH2109膠囊具有良好的安全性,、成藥性及臨床開發(fā)價值。截至目前,,該藥品項目的研發(fā)投入累計約2,500萬元,。 據(jù)悉,2020年3月saroglitazar magnesium藥物治療NASH獲得印度藥物管理局(DCGI)批準上市,,美國和中國暫無與本項目相同靶點相同適應癥的藥品獲批上市,。資料顯示,,saroglitazar magnesium一種新型的過氧化物酶體增殖物活化受體(PPAR)激動劑,,該產(chǎn)品是世界上第一款獲批治療非肝硬化性NASH的藥物。 據(jù)公司年報數(shù)據(jù)顯示,,2019年片仔癀研發(fā)投入接近1.2億元,,同比增長18.47%,在研藥品品種11個,,涉及中藥,、化藥創(chuàng)新藥及仿制藥,除了PZH2111,、PZH2109外,,治療廣泛性焦慮癥新藥PZH1204也值得期待。 來源:CDE官網(wǎng)、米內(nèi)網(wǎng)數(shù)據(jù)庫 審評數(shù)據(jù)統(tǒng)計截至2020年8月17日,,如有錯漏,,敬請指正。