潤寶醫(yī)療網(wǎng)7月10日訊 在日前舉行的第三批全國藥品帶量采購視頻會議上,,新一輪帶量采購工作預(yù)計將于7月份正式啟動,。隨著化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評價工作推進(jìn),理順注射劑一致性評價與帶量采購的關(guān)系,,合理遴選采購品種,,根據(jù)臨床反饋不斷完善治療用藥,謹(jǐn)慎處理臨床藥物替換,,具有重要的現(xiàn)實(shí)意義,。 多組分生化藥工藝復(fù)雜 產(chǎn)品質(zhì)量重點(diǎn)關(guān)注 今年5月,,國家藥品監(jiān)督管理局發(fā)布《國家藥監(jiān)局關(guān)于開展化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評價工作的公告》,藥品審評中心(CDE)隨后配套發(fā)布了《化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評價技術(shù)要求》,,貫徹落實(shí)加快推進(jìn)仿制藥一致性評價的工作部署,。 注射劑本身的特殊給藥途徑和臨床應(yīng)用范圍決定了其高風(fēng)險特點(diǎn),處方,、工藝研究的不徹底,很可能帶來產(chǎn)品質(zhì)量穩(wěn)定性問題,,進(jìn)而造成療效和安全問題,。鑒于注射劑產(chǎn)品高風(fēng)險特點(diǎn),特別是對于一些特殊的注射劑,,如原料藥特別復(fù)雜的生物化學(xué)類藥物等,,一致性評價工作需要合理的政策引導(dǎo)和監(jiān)管。 生物化學(xué)類藥物是以生物材料為原料經(jīng)化學(xué)工藝制得,,與化學(xué)藥物相比,,生物制劑的并非單一成分,而是組分復(fù)雜,,結(jié)構(gòu)難確定,,且對熱、酸,、堿,、重金屬及 pH 均較敏感,生產(chǎn)工藝中易引入特殊雜質(zhì)和污染物等,。以原研依諾肝素鈉為例,,該藥物就是以豬腸黏膜組織為生產(chǎn)起始原料,由于生產(chǎn)工藝復(fù)雜,,到目前為止也只有70%的結(jié)構(gòu)能夠被充分表征,,仍有30%無法表征。 國際上,,歐洲藥品管理局(EMA),、美國食品藥品監(jiān)督管理局(FDA)、世界衛(wèi)生組織(WHO)等機(jī)構(gòu)均認(rèn)識到低分子肝素類藥物(LMWH)的復(fù)雜性,,從藥物原料生產(chǎn)工藝,,到全過程質(zhì)量控制,都對藥物成品質(zhì)量有著決定性影響,。 中國藥品監(jiān)管部門對于包括低分子肝素在內(nèi)的復(fù)雜注射劑的質(zhì)量控制和安全監(jiān)管投入了高度關(guān)注,。早在2008年“肝素鈉事件”中,藥監(jiān)部門在原料中查出“多硫酸軟骨素”是造成多例患者死亡的不能排除的風(fēng)險因素,;近年來,,監(jiān)管機(jī)構(gòu)持續(xù)推進(jìn)相關(guān)品種規(guī)范管理,,包括《中華人民共和國藥典》標(biāo)準(zhǔn)修訂工作,監(jiān)管力度不斷升級,。 低分子肝素替換須合理 帶量采購綜合考量 國家推動的藥品集中帶量采購降低患者費(fèi)用負(fù)擔(dān),,提高了臨床用藥質(zhì)量水平,同時加速企業(yè)間的競爭轉(zhuǎn)為公開透明的產(chǎn)品質(zhì)量和成本競爭,,從根本上改善了醫(yī)藥行業(yè)生態(tài),。出臺注射劑一致性評價政策文件或指導(dǎo)原則,制定評價標(biāo)準(zhǔn)是產(chǎn)品納入帶量采購的基礎(chǔ),。 目前,,中國尚缺乏針對復(fù)雜的生物化學(xué)類注射劑產(chǎn)品的一致性評價技術(shù)指南,最新發(fā)布的《化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評價技術(shù)要求》明確:對于特殊注射劑,,除了按照技術(shù)要求開展研究的同時,,還需根據(jù)特殊注射劑的特點(diǎn),參照FDA,、EMA發(fā)布的特殊注射劑相關(guān)技術(shù)要求,,科學(xué)設(shè)計試驗(yàn)。 基于科學(xué)標(biāo)準(zhǔn)研判,,在藥品納入帶量采購時,,有必要對具有特殊性及高風(fēng)險藥品具體考量。事實(shí)上,,低分子肝素由于生產(chǎn)工藝的不同,,包括依諾肝素鈉、那屈肝素鈣和達(dá)肝素鈉等不同通用名產(chǎn)品,,中國國家藥典委已于2017年6月發(fā)布了關(guān)于依諾肝素鈉,、那屈肝素鈣、達(dá)肝素鈉的草案藥典標(biāo)準(zhǔn),,這些按照藥典分類的低分子肝素產(chǎn)品,,一致性評價工作正在進(jìn)行中,行業(yè)建議對這類產(chǎn)品不納入或延緩納入省級集采,。 此外,,中國低分子肝素市場還有大量不能按照藥典標(biāo)準(zhǔn)歸類到某一通用名、也無法確定參比制劑的低分子肝素產(chǎn)品,。根據(jù)2020年4月第三方機(jī)構(gòu)(IQVIA)數(shù)據(jù)顯示:不能按藥典標(biāo)準(zhǔn)歸類的低分子肝素產(chǎn)品占到整個低分子肝素用量的54%,,這類低分子肝素沒有一致性評價的參比制劑,難以通過BE試驗(yàn)完成一致性評價,,無法參與國家層面的集采,,或是省級集采可以考慮納入的品類。 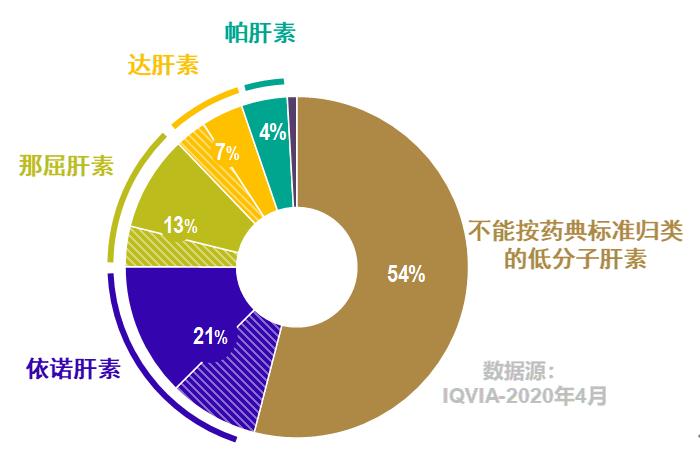 臨床使用方面,,不同低分子肝素的抗Xa與抗IIa比例不同,,歐美的藥品監(jiān)管部門針對低分子肝素之間臨床替換的安全性風(fēng)險高度重視,,尤其是肝素或低分子肝素產(chǎn)品治療可能導(dǎo)致的潛在致死性免疫原性相關(guān)不良事件——肝素誘導(dǎo)的血小板減少癥(HIT)。因此,,仿制產(chǎn)品和原研產(chǎn)品的療效差異等問題,,合理用藥不容忽視。 (MAT-CN-2011120,,截止日期:2022.7.6)
臨床使用方面,,不同低分子肝素的抗Xa與抗IIa比例不同,,歐美的藥品監(jiān)管部門針對低分子肝素之間臨床替換的安全性風(fēng)險高度重視,,尤其是肝素或低分子肝素產(chǎn)品治療可能導(dǎo)致的潛在致死性免疫原性相關(guān)不良事件——肝素誘導(dǎo)的血小板減少癥(HIT)。因此,,仿制產(chǎn)品和原研產(chǎn)品的療效差異等問題,,合理用藥不容忽視。 (MAT-CN-2011120,,截止日期:2022.7.6)
 臨床使用方面,,不同低分子肝素的抗Xa與抗IIa比例不同,,歐美的藥品監(jiān)管部門針對低分子肝素之間臨床替換的安全性風(fēng)險高度重視,,尤其是肝素或低分子肝素產(chǎn)品治療可能導(dǎo)致的潛在致死性免疫原性相關(guān)不良事件——肝素誘導(dǎo)的血小板減少癥(HIT)。因此,,仿制產(chǎn)品和原研產(chǎn)品的療效差異等問題,,合理用藥不容忽視。 (MAT-CN-2011120,,截止日期:2022.7.6)
臨床使用方面,,不同低分子肝素的抗Xa與抗IIa比例不同,,歐美的藥品監(jiān)管部門針對低分子肝素之間臨床替換的安全性風(fēng)險高度重視,,尤其是肝素或低分子肝素產(chǎn)品治療可能導(dǎo)致的潛在致死性免疫原性相關(guān)不良事件——肝素誘導(dǎo)的血小板減少癥(HIT)。因此,,仿制產(chǎn)品和原研產(chǎn)品的療效差異等問題,,合理用藥不容忽視。 (MAT-CN-2011120,,截止日期:2022.7.6)



