醫(yī)藥網(wǎng)2月19日訊 2021年,疫情的陰霾還未完全消退,,多國新冠疫苗研發(fā)快速推進,,為全球經(jīng)濟帶來希望。中國經(jīng)濟率先復(fù)蘇,,醫(yī)藥界頻出重拳,。年初,國家醫(yī)保局發(fā)布“兩定辦法”,,雖說網(wǎng)售處方藥有待明確,,但零售行業(yè)仍看到了利好,。春節(jié)前,,第四批藥品集采開標(biāo),,集采常態(tài)化持續(xù)影響醫(yī)藥行業(yè)的發(fā)展,,進一步倒逼企業(yè)創(chuàng)新轉(zhuǎn)型,。3月1日起,新版醫(yī)保藥品目錄正式啟用,,藥企的日子將更加艱難,。2021,砥礪前行,,方見曙光,!本期推出重磅首仿獲批預(yù)測,以饗讀者,。 首仿藥具有市場和定價優(yōu)勢,,是國內(nèi)藥企布局的重點領(lǐng)域。隨著新藥審評審批制度改革,,首仿藥獲批速度日漸加快,。米內(nèi)網(wǎng)數(shù)據(jù)顯示,新年伊始,,已有超過10款首仿藥(含劑型首仿)獲批上市,,包括恒瑞的鹽酸右美托咪定氯化鈉注射液、齊魯?shù)那蜍仗嫫ム奏て岸纂p胍維格列汀片,、上海宣泰海門的泊沙康唑腸溶片,、天士力的米諾膦酸片、南京海融的他卡西醇軟膏等,。那么還有哪些重磅首仿藥有望于2021年底前獲批上市呢,? 表1:有望于2021年底前誕生首仿的重磅品種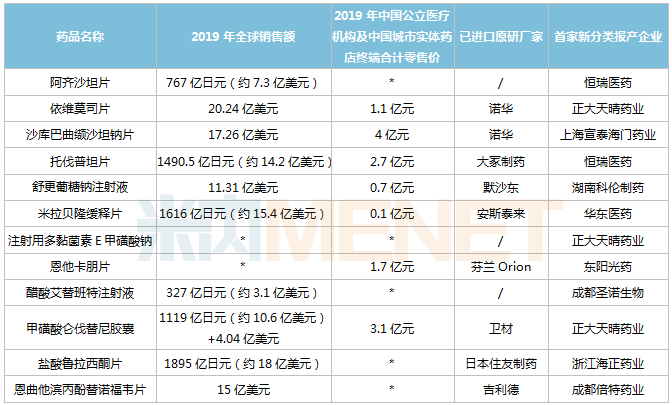 注:無銷售額或低于1000萬元用*代表;預(yù)測數(shù)據(jù),,僅供參考,;首家報產(chǎn)不一定首家獲批 阿齊沙坦片 阿齊沙坦是武田研發(fā)的一款血管緊張素II(AngII)受體拮抗劑,最早于2011年獲得FDA批準(zhǔn)上市,,用于治療高血壓,,2019年全球銷售額達767億日元。 表2:阿齊沙坦片新分類報產(chǎn)情況
注:無銷售額或低于1000萬元用*代表;預(yù)測數(shù)據(jù),,僅供參考,;首家報產(chǎn)不一定首家獲批 阿齊沙坦片 阿齊沙坦是武田研發(fā)的一款血管緊張素II(AngII)受體拮抗劑,最早于2011年獲得FDA批準(zhǔn)上市,,用于治療高血壓,,2019年全球銷售額達767億日元。 表2:阿齊沙坦片新分類報產(chǎn)情況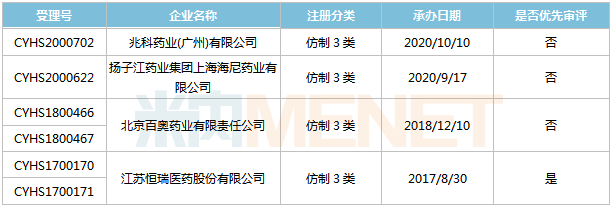 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有4家企業(yè)以仿制3類提交阿齊沙坦片上市申請,。恒瑞醫(yī)藥于2017年8月提交該產(chǎn)品上市申請并獲得CDE承辦受理,,為國內(nèi)首家,同年12月以“專利到期前1年的藥品生產(chǎn)申請”為由納入優(yōu)先審評,,目前處于第二輪資料發(fā)補,。此外,百奧藥業(yè)的產(chǎn)品處于第一輪資料發(fā)補,。 依維莫司片 依維莫司是由諾華研發(fā)的一款哺乳動物雷帕霉素靶蛋白(mTOR)抑制劑,,于2009年在美國獲批上市,,是FDA批準(zhǔn)的首個mTOR抑制劑;2013年2月肝移植后排斥反應(yīng)的新適應(yīng)癥獲批,,是FDA十幾年來首個批準(zhǔn)的肝移植免疫抑制劑,。依維莫司2019年全球銷售額為20.24億美元。 依維莫司片于2013年1月獲批進入國內(nèi)市場,,2017年通過談判納入全國醫(yī)保目錄,,2019年成功續(xù)約并新增報銷適應(yīng)癥。米內(nèi)網(wǎng)數(shù)據(jù)顯示,,該產(chǎn)品在2019年中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端合計銷售額超過1億元,,同比增長29.5%。 表3:依維莫司片新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有4家企業(yè)以仿制3類提交阿齊沙坦片上市申請,。恒瑞醫(yī)藥于2017年8月提交該產(chǎn)品上市申請并獲得CDE承辦受理,,為國內(nèi)首家,同年12月以“專利到期前1年的藥品生產(chǎn)申請”為由納入優(yōu)先審評,,目前處于第二輪資料發(fā)補,。此外,百奧藥業(yè)的產(chǎn)品處于第一輪資料發(fā)補,。 依維莫司片 依維莫司是由諾華研發(fā)的一款哺乳動物雷帕霉素靶蛋白(mTOR)抑制劑,,于2009年在美國獲批上市,,是FDA批準(zhǔn)的首個mTOR抑制劑;2013年2月肝移植后排斥反應(yīng)的新適應(yīng)癥獲批,,是FDA十幾年來首個批準(zhǔn)的肝移植免疫抑制劑,。依維莫司2019年全球銷售額為20.24億美元。 依維莫司片于2013年1月獲批進入國內(nèi)市場,,2017年通過談判納入全國醫(yī)保目錄,,2019年成功續(xù)約并新增報銷適應(yīng)癥。米內(nèi)網(wǎng)數(shù)據(jù)顯示,,該產(chǎn)品在2019年中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端合計銷售額超過1億元,,同比增長29.5%。 表3:依維莫司片新分類報產(chǎn)情況 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)僅正大天晴藥業(yè)的依維莫司片報產(chǎn),,其上市申請于2018年11月獲得CDE承辦受理,,目前已離開新報任務(wù),處于第一輪資料發(fā)補,。 沙庫巴曲纈沙坦鈉片 沙庫巴曲纈沙坦是由沙庫巴曲(腦啡肽酶抑制劑)和纈沙坦(血管緊張素受體拮抗劑)組成的復(fù)方制劑,,于2015年7月獲得FDA批準(zhǔn)上市,是全球首款心衰治療領(lǐng)域的突破性創(chuàng)新藥物,,2019年全球銷售額17.26億美元,。 2017年7月,諾華的沙庫巴曲纈沙坦鈉片獲批進入國內(nèi)市場,,目前已通過談判納入全國醫(yī)保,,2019年在中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端的銷售額超過4億元,同比增長440.1%,。 表4:沙庫巴曲纈沙坦鈉片新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)僅正大天晴藥業(yè)的依維莫司片報產(chǎn),,其上市申請于2018年11月獲得CDE承辦受理,,目前已離開新報任務(wù),處于第一輪資料發(fā)補,。 沙庫巴曲纈沙坦鈉片 沙庫巴曲纈沙坦是由沙庫巴曲(腦啡肽酶抑制劑)和纈沙坦(血管緊張素受體拮抗劑)組成的復(fù)方制劑,,于2015年7月獲得FDA批準(zhǔn)上市,是全球首款心衰治療領(lǐng)域的突破性創(chuàng)新藥物,,2019年全球銷售額17.26億美元,。 2017年7月,諾華的沙庫巴曲纈沙坦鈉片獲批進入國內(nèi)市場,,目前已通過談判納入全國醫(yī)保,,2019年在中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端的銷售額超過4億元,同比增長440.1%,。 表4:沙庫巴曲纈沙坦鈉片新分類報產(chǎn)情況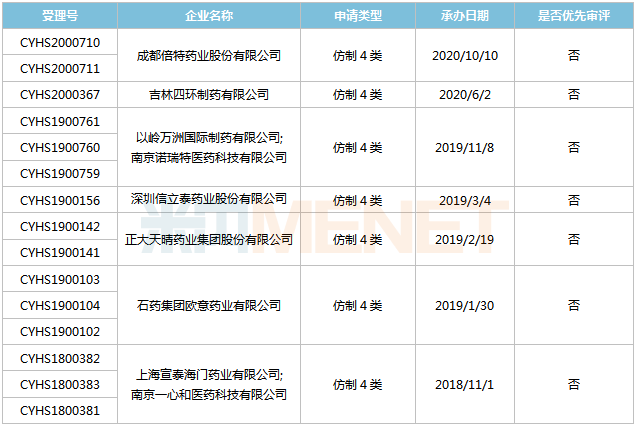 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有7家企業(yè)以仿制4類提交沙庫巴曲纈沙坦鈉片上市申請,,其中上海宣泰海門藥業(yè)最早報產(chǎn),其上市申請于2018年11月獲得CDE承辦受理,,目前正處于第二輪資料發(fā)補。此外,,石藥歐意,、正大天晴等企業(yè)的產(chǎn)品處于第一輪資料發(fā)補。 托伐普坦片 托伐普坦是日本大冢制藥開發(fā)的一款口服選擇性精氨酸加壓素V2受體拮抗劑,,用于治療高容或等容性低鈉血癥伴心力衰竭,、肝硬化、抗利尿激素分泌異常綜合征等,。該產(chǎn)品于2009年5月獲得FDA批準(zhǔn)上市,,是全球首款血管加壓素受體拮抗劑,2019年全球銷售額為1490.5億日元,。 大冢制藥的托伐普坦片于2011年獲批進入國內(nèi)市場,,2017年通過談判納入全國醫(yī)保目錄,,但2019年續(xù)約談判失敗。該產(chǎn)品在2019年中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端合計銷售額為2.7億元,,同比增長46.95%,。 表5:托伐普坦片新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有7家企業(yè)以仿制4類提交沙庫巴曲纈沙坦鈉片上市申請,,其中上海宣泰海門藥業(yè)最早報產(chǎn),其上市申請于2018年11月獲得CDE承辦受理,,目前正處于第二輪資料發(fā)補。此外,,石藥歐意,、正大天晴等企業(yè)的產(chǎn)品處于第一輪資料發(fā)補。 托伐普坦片 托伐普坦是日本大冢制藥開發(fā)的一款口服選擇性精氨酸加壓素V2受體拮抗劑,,用于治療高容或等容性低鈉血癥伴心力衰竭,、肝硬化、抗利尿激素分泌異常綜合征等,。該產(chǎn)品于2009年5月獲得FDA批準(zhǔn)上市,,是全球首款血管加壓素受體拮抗劑,2019年全球銷售額為1490.5億日元,。 大冢制藥的托伐普坦片于2011年獲批進入國內(nèi)市場,,2017年通過談判納入全國醫(yī)保目錄,,但2019年續(xù)約談判失敗。該產(chǎn)品在2019年中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端合計銷售額為2.7億元,,同比增長46.95%,。 表5:托伐普坦片新分類報產(chǎn)情況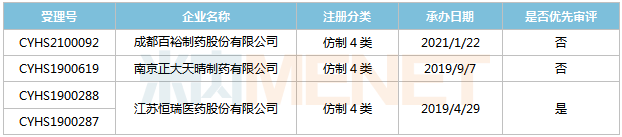 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有3家企業(yè)以仿制4類提交托伐普坦片上市申請,其中恒瑞醫(yī)藥為首家報產(chǎn),,其上市申請于2019年4月獲得CDE承辦受理,并于同年9月納入優(yōu)先審評,。恒瑞醫(yī)藥、南京正大天晴的產(chǎn)品目前均處于第一輪資料發(fā)補,。 舒更葡糖鈉注射液 舒更葡糖鈉是默沙東和歐加農(nóng)開發(fā)的全球首個特異性結(jié)合性神經(jīng)肌肉阻滯拮抗藥物,用于拮抗羅庫溴銨或維庫溴銨誘導(dǎo)的神經(jīng)肌肉阻滯,。該產(chǎn)品最早于2008年9月在歐盟獲批上市,,2015年12月在美國獲批上市,,2019年全球銷售額為11.31億美元,。 2017年5月,舒更葡糖鈉注射液獲批進入國內(nèi)市場,,2019年在中國公立醫(yī)療機構(gòu)終端的銷售額超過7000萬元,,同比增長804.21%,2020年上半年銷售額超過5000萬元,,同比增長117.5%,。 表6:舒更葡糖鈉注射液新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有3家企業(yè)以仿制4類提交托伐普坦片上市申請,其中恒瑞醫(yī)藥為首家報產(chǎn),,其上市申請于2019年4月獲得CDE承辦受理,并于同年9月納入優(yōu)先審評,。恒瑞醫(yī)藥、南京正大天晴的產(chǎn)品目前均處于第一輪資料發(fā)補,。 舒更葡糖鈉注射液 舒更葡糖鈉是默沙東和歐加農(nóng)開發(fā)的全球首個特異性結(jié)合性神經(jīng)肌肉阻滯拮抗藥物,用于拮抗羅庫溴銨或維庫溴銨誘導(dǎo)的神經(jīng)肌肉阻滯,。該產(chǎn)品最早于2008年9月在歐盟獲批上市,,2015年12月在美國獲批上市,,2019年全球銷售額為11.31億美元,。 2017年5月,舒更葡糖鈉注射液獲批進入國內(nèi)市場,,2019年在中國公立醫(yī)療機構(gòu)終端的銷售額超過7000萬元,,同比增長804.21%,2020年上半年銷售額超過5000萬元,,同比增長117.5%,。 表6:舒更葡糖鈉注射液新分類報產(chǎn)情況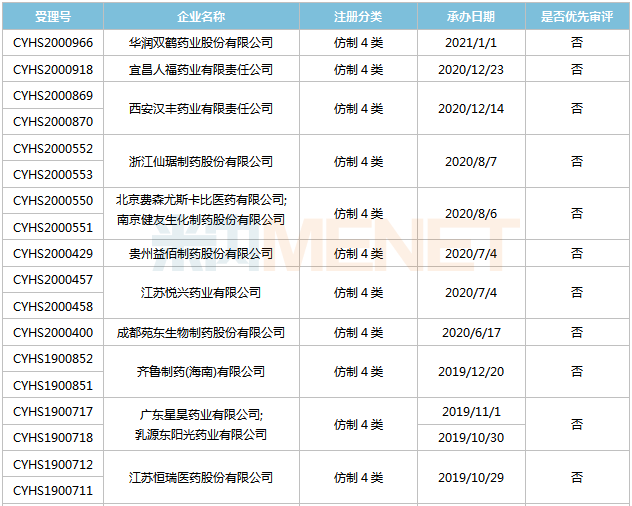
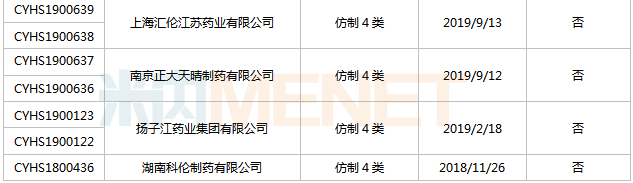 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 舒更葡糖鈉注射液首仿之爭較為激烈,,目前已有15家企業(yè)以仿制4類提交該產(chǎn)品上市申請,,其中湖南科倫首家報產(chǎn),,其上市申請于2018年11月獲得CDE承辦受理,,目前已進入第二輪資料發(fā)補。此外,,揚子江的產(chǎn)品處于第一輪資料發(fā)補。 米拉貝隆緩釋片 米拉貝隆是安斯泰來研發(fā)的一款選擇性β3-腎上腺素能受體激動劑,,主要用于治療膀胱過度活動引起的尿急,、尿頻及尿失禁。該產(chǎn)品最早于2011年9月在日本獲批上市,,2012年6月在美國獲批上市,,2019年全球銷售額為1616億日元。 2017年10月,,安斯泰來的米拉貝隆緩釋片獲批進入國內(nèi)市場,,2018年5月底正式上市銷售,是目前國內(nèi)唯一一款治療膀胱過度活動癥的β3受體激動劑,,2019年在中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端合計銷售額超過1000萬元,2020年通過談判納入全國醫(yī)保目錄后,,有望實現(xiàn)放量,。 表7:米拉貝隆緩釋片新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 舒更葡糖鈉注射液首仿之爭較為激烈,,目前已有15家企業(yè)以仿制4類提交該產(chǎn)品上市申請,,其中湖南科倫首家報產(chǎn),,其上市申請于2018年11月獲得CDE承辦受理,,目前已進入第二輪資料發(fā)補。此外,,揚子江的產(chǎn)品處于第一輪資料發(fā)補。 米拉貝隆緩釋片 米拉貝隆是安斯泰來研發(fā)的一款選擇性β3-腎上腺素能受體激動劑,,主要用于治療膀胱過度活動引起的尿急,、尿頻及尿失禁。該產(chǎn)品最早于2011年9月在日本獲批上市,,2012年6月在美國獲批上市,,2019年全球銷售額為1616億日元。 2017年10月,,安斯泰來的米拉貝隆緩釋片獲批進入國內(nèi)市場,,2018年5月底正式上市銷售,是目前國內(nèi)唯一一款治療膀胱過度活動癥的β3受體激動劑,,2019年在中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端合計銷售額超過1000萬元,2020年通過談判納入全國醫(yī)保目錄后,,有望實現(xiàn)放量,。 表7:米拉貝隆緩釋片新分類報產(chǎn)情況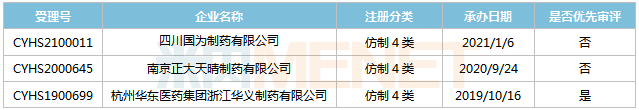 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有3家企業(yè)以仿制4類提交米拉貝隆緩釋片上市申請,,其中華東醫(yī)藥的產(chǎn)品首家報產(chǎn),,其上市申請于2019年10月獲得CDE承辦受理,并于2020年3月以“專利到期前1年的藥品生產(chǎn)申請”為由納入優(yōu)先審評,,目前處于第一輪資料發(fā)補。 注射用多黏菌素E甲磺酸鈉 多黏菌素E甲磺酸鈉屬于多肽類抗生素,,是目前治療多重耐藥銅綠假單胞菌及其他革蘭氏陰性菌引起感染的首選藥物,。該產(chǎn)品耐藥率低且與其它類抗生素不會產(chǎn)生交叉耐藥性,是國內(nèi)急重癥患者急需的超級抗生素,,目前原研產(chǎn)品還未進入國內(nèi)市場,。 表8:注射用多黏菌素E甲磺酸鈉新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有3家企業(yè)以仿制4類提交米拉貝隆緩釋片上市申請,,其中華東醫(yī)藥的產(chǎn)品首家報產(chǎn),,其上市申請于2019年10月獲得CDE承辦受理,并于2020年3月以“專利到期前1年的藥品生產(chǎn)申請”為由納入優(yōu)先審評,,目前處于第一輪資料發(fā)補。 注射用多黏菌素E甲磺酸鈉 多黏菌素E甲磺酸鈉屬于多肽類抗生素,,是目前治療多重耐藥銅綠假單胞菌及其他革蘭氏陰性菌引起感染的首選藥物,。該產(chǎn)品耐藥率低且與其它類抗生素不會產(chǎn)生交叉耐藥性,是國內(nèi)急重癥患者急需的超級抗生素,,目前原研產(chǎn)品還未進入國內(nèi)市場,。 表8:注射用多黏菌素E甲磺酸鈉新分類報產(chǎn)情況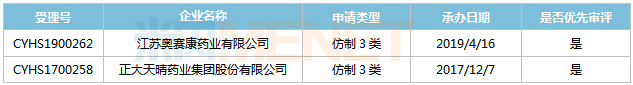 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 正大天晴藥業(yè),、奧賽康分別于2017年12月和2019年4月以仿制3類提交注射用多黏菌素E甲磺酸鈉上市申請,,且均被納入優(yōu)先審評程序,,其中正大天晴藥業(yè)的產(chǎn)品處于第二輪補充資料,奧賽康的產(chǎn)品處于第一輪資料發(fā)補,。 恩他卡朋片 恩他卡朋是由芬蘭Orion公司研發(fā)的一款特異性外周兒茶酚胺-o-甲基轉(zhuǎn)移酶抑制劑,,最早于1998年在歐盟上市,,用于治療左旋多巴/芐絲肼或左旋多巴/卡比多巴不能控制的帕金森病及劑末現(xiàn)象(癥狀波動),。 原研產(chǎn)品于2004年獲批進入國內(nèi)市場,,為全國醫(yī)保乙類產(chǎn)品,限二線用藥,。2019年在中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端恩他卡朋片合計銷售額為1.7億元,,同比增長20.27%,。 表9:恩他卡朋片新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 正大天晴藥業(yè),、奧賽康分別于2017年12月和2019年4月以仿制3類提交注射用多黏菌素E甲磺酸鈉上市申請,,且均被納入優(yōu)先審評程序,,其中正大天晴藥業(yè)的產(chǎn)品處于第二輪補充資料,奧賽康的產(chǎn)品處于第一輪資料發(fā)補,。 恩他卡朋片 恩他卡朋是由芬蘭Orion公司研發(fā)的一款特異性外周兒茶酚胺-o-甲基轉(zhuǎn)移酶抑制劑,,最早于1998年在歐盟上市,,用于治療左旋多巴/芐絲肼或左旋多巴/卡比多巴不能控制的帕金森病及劑末現(xiàn)象(癥狀波動),。 原研產(chǎn)品于2004年獲批進入國內(nèi)市場,,為全國醫(yī)保乙類產(chǎn)品,限二線用藥,。2019年在中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端恩他卡朋片合計銷售額為1.7億元,,同比增長20.27%,。 表9:恩他卡朋片新分類報產(chǎn)情況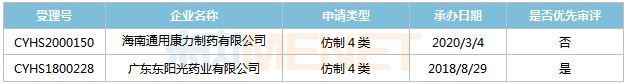 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 東陽光藥,、海南通用康力分別于2018年8月和2020年3月以仿制4類提交恩他卡朋片上市申請,,其中東陽光藥的產(chǎn)品于2018年11月以“同一生產(chǎn)線生產(chǎn),,已于2018年在美國上市,,申請國內(nèi)上市的仿制藥”為由納入優(yōu)先審評,,目前正處于第二輪補充資料,。 醋酸艾替班特注射液 艾替班特是武田旗下Shire公司研發(fā)的一款罕見病用藥,,屬于強力的選擇性的緩激肽B2受體拮抗劑,,主要用于治療遺傳性血管水腫(HAE)急性發(fā)作,。該產(chǎn)品于2008年7月在歐盟獲批上市,,2011年8月在美國獲批上市,是FDA批準(zhǔn)的第3個治療HAE發(fā)作的藥物,,2019年全球銷售額為327億日元。 在國內(nèi),,醋酸艾替班特注射液已被納入臨床急需境外新藥名單,,武田于2020年6月以進口5.1類提交該產(chǎn)品上市申請,目前還處于“在審評審批中(在藥審中心)”狀態(tài),。 表10:醋酸艾替班特注射液新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 東陽光藥,、海南通用康力分別于2018年8月和2020年3月以仿制4類提交恩他卡朋片上市申請,,其中東陽光藥的產(chǎn)品于2018年11月以“同一生產(chǎn)線生產(chǎn),,已于2018年在美國上市,,申請國內(nèi)上市的仿制藥”為由納入優(yōu)先審評,,目前正處于第二輪補充資料,。 醋酸艾替班特注射液 艾替班特是武田旗下Shire公司研發(fā)的一款罕見病用藥,,屬于強力的選擇性的緩激肽B2受體拮抗劑,,主要用于治療遺傳性血管水腫(HAE)急性發(fā)作,。該產(chǎn)品于2008年7月在歐盟獲批上市,,2011年8月在美國獲批上市,是FDA批準(zhǔn)的第3個治療HAE發(fā)作的藥物,,2019年全球銷售額為327億日元。 在國內(nèi),,醋酸艾替班特注射液已被納入臨床急需境外新藥名單,,武田于2020年6月以進口5.1類提交該產(chǎn)品上市申請,目前還處于“在審評審批中(在藥審中心)”狀態(tài),。 表10:醋酸艾替班特注射液新分類報產(chǎn)情況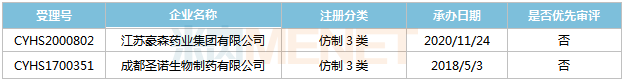 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 成都圣諾,、豪森分別于2018年5月和2020年11月以仿制3類提交醋酸艾替班特注射液上市申請,其中成都圣諾的產(chǎn)品已完成第一輪補充資料,。 甲磺酸侖伐替尼膠囊 侖伐替尼是衛(wèi)材開發(fā)的一款口服多靶點激酶抑制劑,,可抑制VEGFR-1,2,,3,、FGFR-1,2,,3,,4、PDGFR,、RET,、KIT等多個靶點。最早于2012年8月在日本被授予孤兒藥治療甲狀腺癌,,2015年先后在美國,、歐盟正式獲批上市,,2019年全球銷售額約14億美元。 2018年9月,,甲磺酸侖伐替尼膠囊獲批進入國內(nèi)市場,,成為國內(nèi)近10年來首個獲批一線治療晚期肝癌的藥物,2019年在中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端合計銷售額為3.1億元,,2020年通過談判納入全國醫(yī)保目錄,,有望實現(xiàn)新一輪放量。 表11:甲磺酸侖伐替尼膠囊新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 成都圣諾,、豪森分別于2018年5月和2020年11月以仿制3類提交醋酸艾替班特注射液上市申請,其中成都圣諾的產(chǎn)品已完成第一輪補充資料,。 甲磺酸侖伐替尼膠囊 侖伐替尼是衛(wèi)材開發(fā)的一款口服多靶點激酶抑制劑,,可抑制VEGFR-1,2,,3,、FGFR-1,2,,3,,4、PDGFR,、RET,、KIT等多個靶點。最早于2012年8月在日本被授予孤兒藥治療甲狀腺癌,,2015年先后在美國,、歐盟正式獲批上市,,2019年全球銷售額約14億美元。 2018年9月,,甲磺酸侖伐替尼膠囊獲批進入國內(nèi)市場,,成為國內(nèi)近10年來首個獲批一線治療晚期肝癌的藥物,2019年在中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端合計銷售額為3.1億元,,2020年通過談判納入全國醫(yī)保目錄,,有望實現(xiàn)新一輪放量。 表11:甲磺酸侖伐替尼膠囊新分類報產(chǎn)情況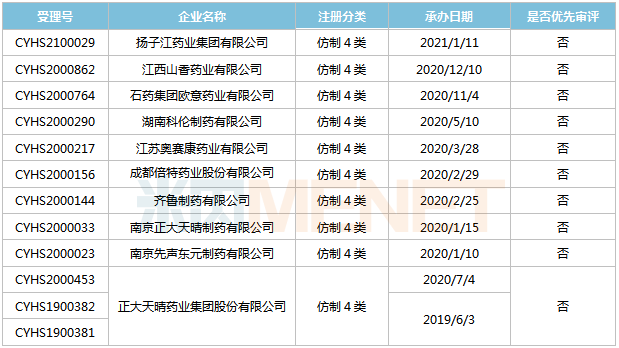 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有10家企業(yè)以仿制4類提交甲磺酸侖伐替尼膠囊上市申請,,正大天晴藥業(yè),、南京先聲東元、南京正大天晴制藥3家企業(yè)的產(chǎn)品均處于第一輪資料發(fā)補,。 鹽酸魯拉西酮片 魯拉西酮是日本住友制藥研發(fā)的一款非典型(第二代)抗精神病藥物,,為多巴胺D2、5-HT2A及5-HT7受體拮抗劑,。該產(chǎn)品最早于2010年10月獲得FDA批準(zhǔn)上市,,2019年1月獲批進入國內(nèi)市場,2019年全球銷售額為1895億日元,,2020年全球銷售額為1942億日元,。 表12:鹽酸魯拉西酮片新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有10家企業(yè)以仿制4類提交甲磺酸侖伐替尼膠囊上市申請,,正大天晴藥業(yè),、南京先聲東元、南京正大天晴制藥3家企業(yè)的產(chǎn)品均處于第一輪資料發(fā)補,。 鹽酸魯拉西酮片 魯拉西酮是日本住友制藥研發(fā)的一款非典型(第二代)抗精神病藥物,,為多巴胺D2、5-HT2A及5-HT7受體拮抗劑,。該產(chǎn)品最早于2010年10月獲得FDA批準(zhǔn)上市,,2019年1月獲批進入國內(nèi)市場,2019年全球銷售額為1895億日元,,2020年全球銷售額為1942億日元,。 表12:鹽酸魯拉西酮片新分類報產(chǎn)情況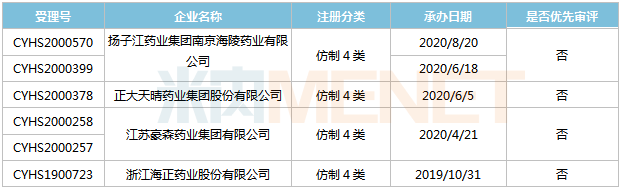 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有4家企業(yè)以仿制4類提交鹽酸魯拉西酮片上市申請,其中海正藥業(yè)首家報產(chǎn),,其上市申請于2019年10月獲得CDE承辦受理,,目前處于第一輪資料發(fā)補。 恩曲他濱丙酚替諾福韋片 恩曲他濱丙酚替諾福韋是一款由恩曲他濱及丙酚替諾福韋組成的復(fù)方制劑,,與其他抗反轉(zhuǎn)錄病毒藥物聯(lián)用,,治療成年和青少年(12歲及以上且體重≥35kg)的HIV-1感染。該產(chǎn)品于2016年獲得FDA批準(zhǔn)上市,,2019年全球銷售額15億美元,。 表13:恩曲他濱丙酚替諾福韋片新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有4家企業(yè)以仿制4類提交鹽酸魯拉西酮片上市申請,其中海正藥業(yè)首家報產(chǎn),,其上市申請于2019年10月獲得CDE承辦受理,,目前處于第一輪資料發(fā)補。 恩曲他濱丙酚替諾福韋片 恩曲他濱丙酚替諾福韋是一款由恩曲他濱及丙酚替諾福韋組成的復(fù)方制劑,,與其他抗反轉(zhuǎn)錄病毒藥物聯(lián)用,,治療成年和青少年(12歲及以上且體重≥35kg)的HIV-1感染。該產(chǎn)品于2016年獲得FDA批準(zhǔn)上市,,2019年全球銷售額15億美元,。 表13:恩曲他濱丙酚替諾福韋片新分類報產(chǎn)情況 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)僅成都倍特藥業(yè)的恩曲他濱丙酚替諾福韋片報產(chǎn),其上市申請于2019年11月獲得CDE承辦受理,,目前已離開新報任務(wù),,處于第一輪資料發(fā)補。 來源:米內(nèi)網(wǎng)數(shù)據(jù)庫 注:數(shù)據(jù)統(tǒng)計截至2月16日,,如有疏漏,,歡迎指正!
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)僅成都倍特藥業(yè)的恩曲他濱丙酚替諾福韋片報產(chǎn),其上市申請于2019年11月獲得CDE承辦受理,,目前已離開新報任務(wù),,處于第一輪資料發(fā)補。 來源:米內(nèi)網(wǎng)數(shù)據(jù)庫 注:數(shù)據(jù)統(tǒng)計截至2月16日,,如有疏漏,,歡迎指正!
 注:無銷售額或低于1000萬元用*代表;預(yù)測數(shù)據(jù),,僅供參考,;首家報產(chǎn)不一定首家獲批 阿齊沙坦片 阿齊沙坦是武田研發(fā)的一款血管緊張素II(AngII)受體拮抗劑,最早于2011年獲得FDA批準(zhǔn)上市,,用于治療高血壓,,2019年全球銷售額達767億日元。 表2:阿齊沙坦片新分類報產(chǎn)情況
注:無銷售額或低于1000萬元用*代表;預(yù)測數(shù)據(jù),,僅供參考,;首家報產(chǎn)不一定首家獲批 阿齊沙坦片 阿齊沙坦是武田研發(fā)的一款血管緊張素II(AngII)受體拮抗劑,最早于2011年獲得FDA批準(zhǔn)上市,,用于治療高血壓,,2019年全球銷售額達767億日元。 表2:阿齊沙坦片新分類報產(chǎn)情況 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有4家企業(yè)以仿制3類提交阿齊沙坦片上市申請,。恒瑞醫(yī)藥于2017年8月提交該產(chǎn)品上市申請并獲得CDE承辦受理,,為國內(nèi)首家,同年12月以“專利到期前1年的藥品生產(chǎn)申請”為由納入優(yōu)先審評,,目前處于第二輪資料發(fā)補,。此外,百奧藥業(yè)的產(chǎn)品處于第一輪資料發(fā)補,。 依維莫司片 依維莫司是由諾華研發(fā)的一款哺乳動物雷帕霉素靶蛋白(mTOR)抑制劑,,于2009年在美國獲批上市,,是FDA批準(zhǔn)的首個mTOR抑制劑;2013年2月肝移植后排斥反應(yīng)的新適應(yīng)癥獲批,,是FDA十幾年來首個批準(zhǔn)的肝移植免疫抑制劑,。依維莫司2019年全球銷售額為20.24億美元。 依維莫司片于2013年1月獲批進入國內(nèi)市場,,2017年通過談判納入全國醫(yī)保目錄,,2019年成功續(xù)約并新增報銷適應(yīng)癥。米內(nèi)網(wǎng)數(shù)據(jù)顯示,,該產(chǎn)品在2019年中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端合計銷售額超過1億元,,同比增長29.5%。 表3:依維莫司片新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有4家企業(yè)以仿制3類提交阿齊沙坦片上市申請,。恒瑞醫(yī)藥于2017年8月提交該產(chǎn)品上市申請并獲得CDE承辦受理,,為國內(nèi)首家,同年12月以“專利到期前1年的藥品生產(chǎn)申請”為由納入優(yōu)先審評,,目前處于第二輪資料發(fā)補,。此外,百奧藥業(yè)的產(chǎn)品處于第一輪資料發(fā)補,。 依維莫司片 依維莫司是由諾華研發(fā)的一款哺乳動物雷帕霉素靶蛋白(mTOR)抑制劑,,于2009年在美國獲批上市,,是FDA批準(zhǔn)的首個mTOR抑制劑;2013年2月肝移植后排斥反應(yīng)的新適應(yīng)癥獲批,,是FDA十幾年來首個批準(zhǔn)的肝移植免疫抑制劑,。依維莫司2019年全球銷售額為20.24億美元。 依維莫司片于2013年1月獲批進入國內(nèi)市場,,2017年通過談判納入全國醫(yī)保目錄,,2019年成功續(xù)約并新增報銷適應(yīng)癥。米內(nèi)網(wǎng)數(shù)據(jù)顯示,,該產(chǎn)品在2019年中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端合計銷售額超過1億元,,同比增長29.5%。 表3:依維莫司片新分類報產(chǎn)情況 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)僅正大天晴藥業(yè)的依維莫司片報產(chǎn),,其上市申請于2018年11月獲得CDE承辦受理,,目前已離開新報任務(wù),處于第一輪資料發(fā)補,。 沙庫巴曲纈沙坦鈉片 沙庫巴曲纈沙坦是由沙庫巴曲(腦啡肽酶抑制劑)和纈沙坦(血管緊張素受體拮抗劑)組成的復(fù)方制劑,,于2015年7月獲得FDA批準(zhǔn)上市,是全球首款心衰治療領(lǐng)域的突破性創(chuàng)新藥物,,2019年全球銷售額17.26億美元,。 2017年7月,諾華的沙庫巴曲纈沙坦鈉片獲批進入國內(nèi)市場,,目前已通過談判納入全國醫(yī)保,,2019年在中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端的銷售額超過4億元,同比增長440.1%,。 表4:沙庫巴曲纈沙坦鈉片新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)僅正大天晴藥業(yè)的依維莫司片報產(chǎn),,其上市申請于2018年11月獲得CDE承辦受理,,目前已離開新報任務(wù),處于第一輪資料發(fā)補,。 沙庫巴曲纈沙坦鈉片 沙庫巴曲纈沙坦是由沙庫巴曲(腦啡肽酶抑制劑)和纈沙坦(血管緊張素受體拮抗劑)組成的復(fù)方制劑,,于2015年7月獲得FDA批準(zhǔn)上市,是全球首款心衰治療領(lǐng)域的突破性創(chuàng)新藥物,,2019年全球銷售額17.26億美元,。 2017年7月,諾華的沙庫巴曲纈沙坦鈉片獲批進入國內(nèi)市場,,目前已通過談判納入全國醫(yī)保,,2019年在中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端的銷售額超過4億元,同比增長440.1%,。 表4:沙庫巴曲纈沙坦鈉片新分類報產(chǎn)情況 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有7家企業(yè)以仿制4類提交沙庫巴曲纈沙坦鈉片上市申請,,其中上海宣泰海門藥業(yè)最早報產(chǎn),其上市申請于2018年11月獲得CDE承辦受理,,目前正處于第二輪資料發(fā)補。此外,,石藥歐意,、正大天晴等企業(yè)的產(chǎn)品處于第一輪資料發(fā)補。 托伐普坦片 托伐普坦是日本大冢制藥開發(fā)的一款口服選擇性精氨酸加壓素V2受體拮抗劑,,用于治療高容或等容性低鈉血癥伴心力衰竭,、肝硬化、抗利尿激素分泌異常綜合征等,。該產(chǎn)品于2009年5月獲得FDA批準(zhǔn)上市,,是全球首款血管加壓素受體拮抗劑,2019年全球銷售額為1490.5億日元,。 大冢制藥的托伐普坦片于2011年獲批進入國內(nèi)市場,,2017年通過談判納入全國醫(yī)保目錄,,但2019年續(xù)約談判失敗。該產(chǎn)品在2019年中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端合計銷售額為2.7億元,,同比增長46.95%,。 表5:托伐普坦片新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有7家企業(yè)以仿制4類提交沙庫巴曲纈沙坦鈉片上市申請,,其中上海宣泰海門藥業(yè)最早報產(chǎn),其上市申請于2018年11月獲得CDE承辦受理,,目前正處于第二輪資料發(fā)補。此外,,石藥歐意,、正大天晴等企業(yè)的產(chǎn)品處于第一輪資料發(fā)補。 托伐普坦片 托伐普坦是日本大冢制藥開發(fā)的一款口服選擇性精氨酸加壓素V2受體拮抗劑,,用于治療高容或等容性低鈉血癥伴心力衰竭,、肝硬化、抗利尿激素分泌異常綜合征等,。該產(chǎn)品于2009年5月獲得FDA批準(zhǔn)上市,,是全球首款血管加壓素受體拮抗劑,2019年全球銷售額為1490.5億日元,。 大冢制藥的托伐普坦片于2011年獲批進入國內(nèi)市場,,2017年通過談判納入全國醫(yī)保目錄,,但2019年續(xù)約談判失敗。該產(chǎn)品在2019年中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端合計銷售額為2.7億元,,同比增長46.95%,。 表5:托伐普坦片新分類報產(chǎn)情況 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有3家企業(yè)以仿制4類提交托伐普坦片上市申請,其中恒瑞醫(yī)藥為首家報產(chǎn),,其上市申請于2019年4月獲得CDE承辦受理,并于同年9月納入優(yōu)先審評,。恒瑞醫(yī)藥、南京正大天晴的產(chǎn)品目前均處于第一輪資料發(fā)補,。 舒更葡糖鈉注射液 舒更葡糖鈉是默沙東和歐加農(nóng)開發(fā)的全球首個特異性結(jié)合性神經(jīng)肌肉阻滯拮抗藥物,用于拮抗羅庫溴銨或維庫溴銨誘導(dǎo)的神經(jīng)肌肉阻滯,。該產(chǎn)品最早于2008年9月在歐盟獲批上市,,2015年12月在美國獲批上市,,2019年全球銷售額為11.31億美元,。 2017年5月,舒更葡糖鈉注射液獲批進入國內(nèi)市場,,2019年在中國公立醫(yī)療機構(gòu)終端的銷售額超過7000萬元,,同比增長804.21%,2020年上半年銷售額超過5000萬元,,同比增長117.5%,。 表6:舒更葡糖鈉注射液新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有3家企業(yè)以仿制4類提交托伐普坦片上市申請,其中恒瑞醫(yī)藥為首家報產(chǎn),,其上市申請于2019年4月獲得CDE承辦受理,并于同年9月納入優(yōu)先審評,。恒瑞醫(yī)藥、南京正大天晴的產(chǎn)品目前均處于第一輪資料發(fā)補,。 舒更葡糖鈉注射液 舒更葡糖鈉是默沙東和歐加農(nóng)開發(fā)的全球首個特異性結(jié)合性神經(jīng)肌肉阻滯拮抗藥物,用于拮抗羅庫溴銨或維庫溴銨誘導(dǎo)的神經(jīng)肌肉阻滯,。該產(chǎn)品最早于2008年9月在歐盟獲批上市,,2015年12月在美國獲批上市,,2019年全球銷售額為11.31億美元,。 2017年5月,舒更葡糖鈉注射液獲批進入國內(nèi)市場,,2019年在中國公立醫(yī)療機構(gòu)終端的銷售額超過7000萬元,,同比增長804.21%,2020年上半年銷售額超過5000萬元,,同比增長117.5%,。 表6:舒更葡糖鈉注射液新分類報產(chǎn)情況
 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 舒更葡糖鈉注射液首仿之爭較為激烈,,目前已有15家企業(yè)以仿制4類提交該產(chǎn)品上市申請,,其中湖南科倫首家報產(chǎn),,其上市申請于2018年11月獲得CDE承辦受理,,目前已進入第二輪資料發(fā)補。此外,,揚子江的產(chǎn)品處于第一輪資料發(fā)補。 米拉貝隆緩釋片 米拉貝隆是安斯泰來研發(fā)的一款選擇性β3-腎上腺素能受體激動劑,,主要用于治療膀胱過度活動引起的尿急,、尿頻及尿失禁。該產(chǎn)品最早于2011年9月在日本獲批上市,,2012年6月在美國獲批上市,,2019年全球銷售額為1616億日元。 2017年10月,,安斯泰來的米拉貝隆緩釋片獲批進入國內(nèi)市場,,2018年5月底正式上市銷售,是目前國內(nèi)唯一一款治療膀胱過度活動癥的β3受體激動劑,,2019年在中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端合計銷售額超過1000萬元,2020年通過談判納入全國醫(yī)保目錄后,,有望實現(xiàn)放量,。 表7:米拉貝隆緩釋片新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 舒更葡糖鈉注射液首仿之爭較為激烈,,目前已有15家企業(yè)以仿制4類提交該產(chǎn)品上市申請,,其中湖南科倫首家報產(chǎn),,其上市申請于2018年11月獲得CDE承辦受理,,目前已進入第二輪資料發(fā)補。此外,,揚子江的產(chǎn)品處于第一輪資料發(fā)補。 米拉貝隆緩釋片 米拉貝隆是安斯泰來研發(fā)的一款選擇性β3-腎上腺素能受體激動劑,,主要用于治療膀胱過度活動引起的尿急,、尿頻及尿失禁。該產(chǎn)品最早于2011年9月在日本獲批上市,,2012年6月在美國獲批上市,,2019年全球銷售額為1616億日元。 2017年10月,,安斯泰來的米拉貝隆緩釋片獲批進入國內(nèi)市場,,2018年5月底正式上市銷售,是目前國內(nèi)唯一一款治療膀胱過度活動癥的β3受體激動劑,,2019年在中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端合計銷售額超過1000萬元,2020年通過談判納入全國醫(yī)保目錄后,,有望實現(xiàn)放量,。 表7:米拉貝隆緩釋片新分類報產(chǎn)情況 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有3家企業(yè)以仿制4類提交米拉貝隆緩釋片上市申請,,其中華東醫(yī)藥的產(chǎn)品首家報產(chǎn),,其上市申請于2019年10月獲得CDE承辦受理,并于2020年3月以“專利到期前1年的藥品生產(chǎn)申請”為由納入優(yōu)先審評,,目前處于第一輪資料發(fā)補。 注射用多黏菌素E甲磺酸鈉 多黏菌素E甲磺酸鈉屬于多肽類抗生素,,是目前治療多重耐藥銅綠假單胞菌及其他革蘭氏陰性菌引起感染的首選藥物,。該產(chǎn)品耐藥率低且與其它類抗生素不會產(chǎn)生交叉耐藥性,是國內(nèi)急重癥患者急需的超級抗生素,,目前原研產(chǎn)品還未進入國內(nèi)市場,。 表8:注射用多黏菌素E甲磺酸鈉新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有3家企業(yè)以仿制4類提交米拉貝隆緩釋片上市申請,,其中華東醫(yī)藥的產(chǎn)品首家報產(chǎn),,其上市申請于2019年10月獲得CDE承辦受理,并于2020年3月以“專利到期前1年的藥品生產(chǎn)申請”為由納入優(yōu)先審評,,目前處于第一輪資料發(fā)補。 注射用多黏菌素E甲磺酸鈉 多黏菌素E甲磺酸鈉屬于多肽類抗生素,,是目前治療多重耐藥銅綠假單胞菌及其他革蘭氏陰性菌引起感染的首選藥物,。該產(chǎn)品耐藥率低且與其它類抗生素不會產(chǎn)生交叉耐藥性,是國內(nèi)急重癥患者急需的超級抗生素,,目前原研產(chǎn)品還未進入國內(nèi)市場,。 表8:注射用多黏菌素E甲磺酸鈉新分類報產(chǎn)情況 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 正大天晴藥業(yè),、奧賽康分別于2017年12月和2019年4月以仿制3類提交注射用多黏菌素E甲磺酸鈉上市申請,,且均被納入優(yōu)先審評程序,,其中正大天晴藥業(yè)的產(chǎn)品處于第二輪補充資料,奧賽康的產(chǎn)品處于第一輪資料發(fā)補,。 恩他卡朋片 恩他卡朋是由芬蘭Orion公司研發(fā)的一款特異性外周兒茶酚胺-o-甲基轉(zhuǎn)移酶抑制劑,,最早于1998年在歐盟上市,,用于治療左旋多巴/芐絲肼或左旋多巴/卡比多巴不能控制的帕金森病及劑末現(xiàn)象(癥狀波動),。 原研產(chǎn)品于2004年獲批進入國內(nèi)市場,,為全國醫(yī)保乙類產(chǎn)品,限二線用藥,。2019年在中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端恩他卡朋片合計銷售額為1.7億元,,同比增長20.27%,。 表9:恩他卡朋片新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 正大天晴藥業(yè),、奧賽康分別于2017年12月和2019年4月以仿制3類提交注射用多黏菌素E甲磺酸鈉上市申請,,且均被納入優(yōu)先審評程序,,其中正大天晴藥業(yè)的產(chǎn)品處于第二輪補充資料,奧賽康的產(chǎn)品處于第一輪資料發(fā)補,。 恩他卡朋片 恩他卡朋是由芬蘭Orion公司研發(fā)的一款特異性外周兒茶酚胺-o-甲基轉(zhuǎn)移酶抑制劑,,最早于1998年在歐盟上市,,用于治療左旋多巴/芐絲肼或左旋多巴/卡比多巴不能控制的帕金森病及劑末現(xiàn)象(癥狀波動),。 原研產(chǎn)品于2004年獲批進入國內(nèi)市場,,為全國醫(yī)保乙類產(chǎn)品,限二線用藥,。2019年在中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端恩他卡朋片合計銷售額為1.7億元,,同比增長20.27%,。 表9:恩他卡朋片新分類報產(chǎn)情況 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 東陽光藥,、海南通用康力分別于2018年8月和2020年3月以仿制4類提交恩他卡朋片上市申請,,其中東陽光藥的產(chǎn)品于2018年11月以“同一生產(chǎn)線生產(chǎn),,已于2018年在美國上市,,申請國內(nèi)上市的仿制藥”為由納入優(yōu)先審評,,目前正處于第二輪補充資料,。 醋酸艾替班特注射液 艾替班特是武田旗下Shire公司研發(fā)的一款罕見病用藥,,屬于強力的選擇性的緩激肽B2受體拮抗劑,,主要用于治療遺傳性血管水腫(HAE)急性發(fā)作,。該產(chǎn)品于2008年7月在歐盟獲批上市,,2011年8月在美國獲批上市,是FDA批準(zhǔn)的第3個治療HAE發(fā)作的藥物,,2019年全球銷售額為327億日元。 在國內(nèi),,醋酸艾替班特注射液已被納入臨床急需境外新藥名單,,武田于2020年6月以進口5.1類提交該產(chǎn)品上市申請,目前還處于“在審評審批中(在藥審中心)”狀態(tài),。 表10:醋酸艾替班特注射液新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 東陽光藥,、海南通用康力分別于2018年8月和2020年3月以仿制4類提交恩他卡朋片上市申請,,其中東陽光藥的產(chǎn)品于2018年11月以“同一生產(chǎn)線生產(chǎn),,已于2018年在美國上市,,申請國內(nèi)上市的仿制藥”為由納入優(yōu)先審評,,目前正處于第二輪補充資料,。 醋酸艾替班特注射液 艾替班特是武田旗下Shire公司研發(fā)的一款罕見病用藥,,屬于強力的選擇性的緩激肽B2受體拮抗劑,,主要用于治療遺傳性血管水腫(HAE)急性發(fā)作,。該產(chǎn)品于2008年7月在歐盟獲批上市,,2011年8月在美國獲批上市,是FDA批準(zhǔn)的第3個治療HAE發(fā)作的藥物,,2019年全球銷售額為327億日元。 在國內(nèi),,醋酸艾替班特注射液已被納入臨床急需境外新藥名單,,武田于2020年6月以進口5.1類提交該產(chǎn)品上市申請,目前還處于“在審評審批中(在藥審中心)”狀態(tài),。 表10:醋酸艾替班特注射液新分類報產(chǎn)情況 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 成都圣諾,、豪森分別于2018年5月和2020年11月以仿制3類提交醋酸艾替班特注射液上市申請,其中成都圣諾的產(chǎn)品已完成第一輪補充資料,。 甲磺酸侖伐替尼膠囊 侖伐替尼是衛(wèi)材開發(fā)的一款口服多靶點激酶抑制劑,,可抑制VEGFR-1,2,,3,、FGFR-1,2,,3,,4、PDGFR,、RET,、KIT等多個靶點。最早于2012年8月在日本被授予孤兒藥治療甲狀腺癌,,2015年先后在美國,、歐盟正式獲批上市,,2019年全球銷售額約14億美元。 2018年9月,,甲磺酸侖伐替尼膠囊獲批進入國內(nèi)市場,,成為國內(nèi)近10年來首個獲批一線治療晚期肝癌的藥物,2019年在中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端合計銷售額為3.1億元,,2020年通過談判納入全國醫(yī)保目錄,,有望實現(xiàn)新一輪放量。 表11:甲磺酸侖伐替尼膠囊新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 成都圣諾,、豪森分別于2018年5月和2020年11月以仿制3類提交醋酸艾替班特注射液上市申請,其中成都圣諾的產(chǎn)品已完成第一輪補充資料,。 甲磺酸侖伐替尼膠囊 侖伐替尼是衛(wèi)材開發(fā)的一款口服多靶點激酶抑制劑,,可抑制VEGFR-1,2,,3,、FGFR-1,2,,3,,4、PDGFR,、RET,、KIT等多個靶點。最早于2012年8月在日本被授予孤兒藥治療甲狀腺癌,,2015年先后在美國,、歐盟正式獲批上市,,2019年全球銷售額約14億美元。 2018年9月,,甲磺酸侖伐替尼膠囊獲批進入國內(nèi)市場,,成為國內(nèi)近10年來首個獲批一線治療晚期肝癌的藥物,2019年在中國公立醫(yī)療機構(gòu)及中國城市實體藥店終端合計銷售額為3.1億元,,2020年通過談判納入全國醫(yī)保目錄,,有望實現(xiàn)新一輪放量。 表11:甲磺酸侖伐替尼膠囊新分類報產(chǎn)情況 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有10家企業(yè)以仿制4類提交甲磺酸侖伐替尼膠囊上市申請,,正大天晴藥業(yè),、南京先聲東元、南京正大天晴制藥3家企業(yè)的產(chǎn)品均處于第一輪資料發(fā)補,。 鹽酸魯拉西酮片 魯拉西酮是日本住友制藥研發(fā)的一款非典型(第二代)抗精神病藥物,,為多巴胺D2、5-HT2A及5-HT7受體拮抗劑,。該產(chǎn)品最早于2010年10月獲得FDA批準(zhǔn)上市,,2019年1月獲批進入國內(nèi)市場,2019年全球銷售額為1895億日元,,2020年全球銷售額為1942億日元,。 表12:鹽酸魯拉西酮片新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有10家企業(yè)以仿制4類提交甲磺酸侖伐替尼膠囊上市申請,,正大天晴藥業(yè),、南京先聲東元、南京正大天晴制藥3家企業(yè)的產(chǎn)品均處于第一輪資料發(fā)補,。 鹽酸魯拉西酮片 魯拉西酮是日本住友制藥研發(fā)的一款非典型(第二代)抗精神病藥物,,為多巴胺D2、5-HT2A及5-HT7受體拮抗劑,。該產(chǎn)品最早于2010年10月獲得FDA批準(zhǔn)上市,,2019年1月獲批進入國內(nèi)市場,2019年全球銷售額為1895億日元,,2020年全球銷售額為1942億日元,。 表12:鹽酸魯拉西酮片新分類報產(chǎn)情況 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有4家企業(yè)以仿制4類提交鹽酸魯拉西酮片上市申請,其中海正藥業(yè)首家報產(chǎn),,其上市申請于2019年10月獲得CDE承辦受理,,目前處于第一輪資料發(fā)補。 恩曲他濱丙酚替諾福韋片 恩曲他濱丙酚替諾福韋是一款由恩曲他濱及丙酚替諾福韋組成的復(fù)方制劑,,與其他抗反轉(zhuǎn)錄病毒藥物聯(lián)用,,治療成年和青少年(12歲及以上且體重≥35kg)的HIV-1感染。該產(chǎn)品于2016年獲得FDA批準(zhǔn)上市,,2019年全球銷售額15億美元,。 表13:恩曲他濱丙酚替諾福韋片新分類報產(chǎn)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)有4家企業(yè)以仿制4類提交鹽酸魯拉西酮片上市申請,其中海正藥業(yè)首家報產(chǎn),,其上市申請于2019年10月獲得CDE承辦受理,,目前處于第一輪資料發(fā)補。 恩曲他濱丙酚替諾福韋片 恩曲他濱丙酚替諾福韋是一款由恩曲他濱及丙酚替諾福韋組成的復(fù)方制劑,,與其他抗反轉(zhuǎn)錄病毒藥物聯(lián)用,,治療成年和青少年(12歲及以上且體重≥35kg)的HIV-1感染。該產(chǎn)品于2016年獲得FDA批準(zhǔn)上市,,2019年全球銷售額15億美元,。 表13:恩曲他濱丙酚替諾福韋片新分類報產(chǎn)情況 來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)僅成都倍特藥業(yè)的恩曲他濱丙酚替諾福韋片報產(chǎn),其上市申請于2019年11月獲得CDE承辦受理,,目前已離開新報任務(wù),,處于第一輪資料發(fā)補。 來源:米內(nèi)網(wǎng)數(shù)據(jù)庫 注:數(shù)據(jù)統(tǒng)計截至2月16日,,如有疏漏,,歡迎指正!
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 目前國內(nèi)僅成都倍特藥業(yè)的恩曲他濱丙酚替諾福韋片報產(chǎn),其上市申請于2019年11月獲得CDE承辦受理,,目前已離開新報任務(wù),,處于第一輪資料發(fā)補。 來源:米內(nèi)網(wǎng)數(shù)據(jù)庫 注:數(shù)據(jù)統(tǒng)計截至2月16日,,如有疏漏,,歡迎指正!