醫(yī)藥網(wǎng)5月8日訊 今年以來,新冠肺炎疫情席卷全球,,美國在應對疫情的同時,,F(xiàn)DA的新藥審批依舊給力。4月,,F(xiàn)DA陸續(xù)批出5款創(chuàng)新藥,,包括4款生物藥和1款化學藥。 圖1:2000年至今FDA批準的新藥數(shù)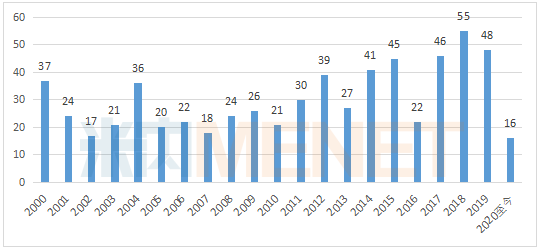 2020年4月,,美國FDA批準5款創(chuàng)新藥,,其中包括治療1型神經(jīng)纖維瘤病的Koselugo、治療膽管癌的Pemazyre,、治療HER2陽性乳腺癌的Tukysa,、治療三陰乳腺癌的Trodelvy,以及治療帕金森病的Ongentys,。獲批上市的新藥含金量極重,,囊括多個突破性療法、多個首款,。 全球藥物研發(fā)市場的趨勢風口,,在4月獲批的新藥上表現(xiàn)得淋漓盡致。一方面生物藥是目前全球最具投資價值的醫(yī)藥細分領域,。憑借生物藥卓越的療效,,2019年全球最暢銷10款藥物中有7款是生物藥,排在榜首的是“藥王”阿達木單抗,。4月批準的創(chuàng)新藥有4款是生物藥,,包括3款單抗和1款ADC藥物,可謂相當亮眼,。另一方面腫瘤藥市場火熱依舊,。腫瘤因為發(fā)病機制的迥異,且患者人群龐大,,是各大研發(fā)企業(yè)競相角逐的大蛋糕,。4月批準的創(chuàng)新藥中抗腫瘤藥占80%,無論是罕見瘤種1型神經(jīng)纖維瘤病,、膽管癌,,還是高發(fā)瘤種乳腺癌,讓患者擁有新希望,。 表1:FDA批準新藥的詳細信息
2020年4月,,美國FDA批準5款創(chuàng)新藥,,其中包括治療1型神經(jīng)纖維瘤病的Koselugo、治療膽管癌的Pemazyre,、治療HER2陽性乳腺癌的Tukysa,、治療三陰乳腺癌的Trodelvy,以及治療帕金森病的Ongentys,。獲批上市的新藥含金量極重,,囊括多個突破性療法、多個首款,。 全球藥物研發(fā)市場的趨勢風口,,在4月獲批的新藥上表現(xiàn)得淋漓盡致。一方面生物藥是目前全球最具投資價值的醫(yī)藥細分領域,。憑借生物藥卓越的療效,,2019年全球最暢銷10款藥物中有7款是生物藥,排在榜首的是“藥王”阿達木單抗,。4月批準的創(chuàng)新藥有4款是生物藥,,包括3款單抗和1款ADC藥物,可謂相當亮眼,。另一方面腫瘤藥市場火熱依舊,。腫瘤因為發(fā)病機制的迥異,且患者人群龐大,,是各大研發(fā)企業(yè)競相角逐的大蛋糕,。4月批準的創(chuàng)新藥中抗腫瘤藥占80%,無論是罕見瘤種1型神經(jīng)纖維瘤病,、膽管癌,,還是高發(fā)瘤種乳腺癌,讓患者擁有新希望,。 表1:FDA批準新藥的詳細信息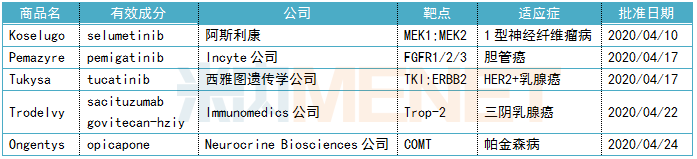 零的突破 Koselugo(selumetinib) 4月10日,,美國FDA批準阿斯利康的激酶抑制劑Koselugo(selumetinib)上市,用于2歲及2歲以上患有1型神經(jīng)纖維瘤病(NF1)的兒童治療癥狀性,、無法手術切除的叢狀神經(jīng)纖維瘤(PN),。Koselugo是1型神經(jīng)纖維瘤病領域的突破,成為首款獲得FDA批準用于治療該病的藥物,。此前,,Koselugo已獲得FDA授予的孤兒藥資格、罕見兒科疾病用藥,、突破性療法認定和優(yōu)先審評資格等資格認定,。目前,該藥也已向歐洲藥品管理局(EMA)提交了上市申請,。
零的突破 Koselugo(selumetinib) 4月10日,,美國FDA批準阿斯利康的激酶抑制劑Koselugo(selumetinib)上市,用于2歲及2歲以上患有1型神經(jīng)纖維瘤病(NF1)的兒童治療癥狀性,、無法手術切除的叢狀神經(jīng)纖維瘤(PN),。Koselugo是1型神經(jīng)纖維瘤病領域的突破,成為首款獲得FDA批準用于治療該病的藥物,。此前,,Koselugo已獲得FDA授予的孤兒藥資格、罕見兒科疾病用藥,、突破性療法認定和優(yōu)先審評資格等資格認定,。目前,該藥也已向歐洲藥品管理局(EMA)提交了上市申請,。  1型神經(jīng)纖維瘤病是一種罕見的,、令人衰弱的遺傳病,大約3000~4000個新生兒就有1個患病,。30%-50%左右的1型神經(jīng)纖維瘤病患者神經(jīng)鞘內(nèi)會生長叢狀神經(jīng)纖維瘤,。這些叢狀神經(jīng)纖維瘤可引起很多臨床問題,如疼痛,、運動障礙,、氣道功能障礙、腸/膀胱功能障礙和畸形,。此次批準主要基于美國國家癌癥研究所的一項臨床試驗,。試驗結果表明,Koselugo作為口服單藥治療的總緩解率(ORR)達66%(50例患者中有33例確診為部分緩解),,這些患者中,,82%的患者緩解持續(xù)時間達到了12個月或更長。 Koselugo的活性成分selumetinib是一款選擇性MEK1/2激酶抑制劑,,MEK是RAS/MAPK信號通路中的關鍵蛋白激酶,而NF1的發(fā)病正是由于NF1基因突變擾亂了RAS/MAPK信號通路所導致的腫瘤生長,。目前,,由阿斯利康申報的selumetinib膠囊已獲得我國臨床默示許可,用于3歲及3歲以上兒童和青少年患有癥狀性和/或進展性,、無法手術的1型神經(jīng)纖維瘤相關叢狀神經(jīng)纖維瘤治療,。 表2:selumetinib膠囊獲批臨床信息
1型神經(jīng)纖維瘤病是一種罕見的,、令人衰弱的遺傳病,大約3000~4000個新生兒就有1個患病,。30%-50%左右的1型神經(jīng)纖維瘤病患者神經(jīng)鞘內(nèi)會生長叢狀神經(jīng)纖維瘤,。這些叢狀神經(jīng)纖維瘤可引起很多臨床問題,如疼痛,、運動障礙,、氣道功能障礙、腸/膀胱功能障礙和畸形,。此次批準主要基于美國國家癌癥研究所的一項臨床試驗,。試驗結果表明,Koselugo作為口服單藥治療的總緩解率(ORR)達66%(50例患者中有33例確診為部分緩解),,這些患者中,,82%的患者緩解持續(xù)時間達到了12個月或更長。 Koselugo的活性成分selumetinib是一款選擇性MEK1/2激酶抑制劑,,MEK是RAS/MAPK信號通路中的關鍵蛋白激酶,而NF1的發(fā)病正是由于NF1基因突變擾亂了RAS/MAPK信號通路所導致的腫瘤生長,。目前,,由阿斯利康申報的selumetinib膠囊已獲得我國臨床默示許可,用于3歲及3歲以上兒童和青少年患有癥狀性和/或進展性,、無法手術的1型神經(jīng)纖維瘤相關叢狀神經(jīng)纖維瘤治療,。 表2:selumetinib膠囊獲批臨床信息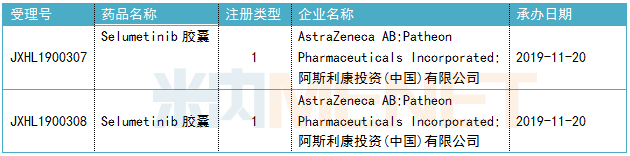 信達再下一城 Pemazyre(pemigatinib) 4月20日,信達生物宣布,,美國FDA加速批準其合作伙伴Incyte公司靶向抗癌藥Pemazyre(pemigatinib)上市,,用于治療既往接受過治療、采用FDA批準方法檢測的具有FGFR2基因融合或其他重排且不可手術切除的局部晚期或轉移性膽管癌成人患者,。Pemazyre沖膽管癌傳統(tǒng)治療的困境,,是首款獲得批準用于治療膽管癌的靶向藥物。此前,Pemazyre已獲得FDA授予的突破新療法,、孤兒藥,、優(yōu)先審批等多項資格認定。
信達再下一城 Pemazyre(pemigatinib) 4月20日,信達生物宣布,,美國FDA加速批準其合作伙伴Incyte公司靶向抗癌藥Pemazyre(pemigatinib)上市,,用于治療既往接受過治療、采用FDA批準方法檢測的具有FGFR2基因融合或其他重排且不可手術切除的局部晚期或轉移性膽管癌成人患者,。Pemazyre沖膽管癌傳統(tǒng)治療的困境,,是首款獲得批準用于治療膽管癌的靶向藥物。此前,Pemazyre已獲得FDA授予的突破新療法,、孤兒藥,、優(yōu)先審批等多項資格認定。 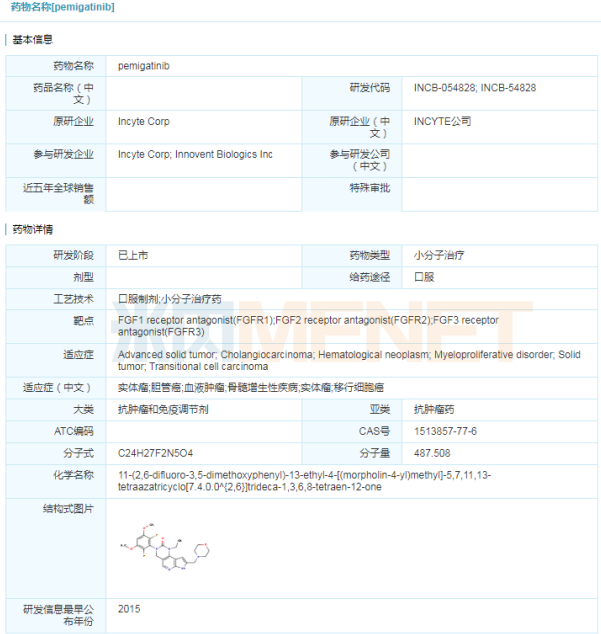 優(yōu)異的臨床試驗數(shù)據(jù)為Pemazyre獲批奠定堅實的基礎,。在一項名為FIGHT-202的國際多中心,、開放性、單臂2期臨床研究中,,Pemazyre治療存在FGFR2融合/重排患者的客觀緩解率達35.5%,,疾病控制率超過80%,且起效迅速,、作用持久,。Pemazyre為膽管癌患者帶來更高質(zhì)量生存的希望。 2018年末,,信達生物和Incyte公司就Incyte的3個臨床階段候選藥物達成了戰(zhàn)略合作,,包括pemigatinib、itacitinib和parsaclisib,。信達生物擁有以上3個藥物在中國(包括香港/澳門,、臺灣地區(qū))的開發(fā)和商業(yè)化權利。pemigatinib國內(nèi)已啟動2期臨床試驗,,信達生物在2020年3月宣布pemigatinib完成中國首例患者給藥,。 “女性殺手”組合藥 Tukysa(tucatinib) 4月18日,西雅圖遺傳學公司宣布,,其靶向抗癌藥Tukysa(tucatinib)獲得美國FDA批準,,與曲妥珠單抗和卡培他濱聯(lián)合使用,治療此前已接受至少一次抗人表皮生長因子受體-2(HER2)療法的晚期無法切除或轉移性HER2陽性的乳腺癌成人患者,,包括發(fā)生腦轉移的患者,。Tukysa是一種靶向HER2的口服小分子酪氨酸激酶抑制劑(TKI),此前已獲得FDA授予的孤兒藥資格,、突破性藥物資格和優(yōu)先審查,。相比FDA目標行動日期提前了4個月獲批的Tukysa目前也在接受歐洲藥品管理局(EMA)的審查。
優(yōu)異的臨床試驗數(shù)據(jù)為Pemazyre獲批奠定堅實的基礎,。在一項名為FIGHT-202的國際多中心,、開放性、單臂2期臨床研究中,,Pemazyre治療存在FGFR2融合/重排患者的客觀緩解率達35.5%,,疾病控制率超過80%,且起效迅速,、作用持久,。Pemazyre為膽管癌患者帶來更高質(zhì)量生存的希望。 2018年末,,信達生物和Incyte公司就Incyte的3個臨床階段候選藥物達成了戰(zhàn)略合作,,包括pemigatinib、itacitinib和parsaclisib,。信達生物擁有以上3個藥物在中國(包括香港/澳門,、臺灣地區(qū))的開發(fā)和商業(yè)化權利。pemigatinib國內(nèi)已啟動2期臨床試驗,,信達生物在2020年3月宣布pemigatinib完成中國首例患者給藥,。 “女性殺手”組合藥 Tukysa(tucatinib) 4月18日,西雅圖遺傳學公司宣布,,其靶向抗癌藥Tukysa(tucatinib)獲得美國FDA批準,,與曲妥珠單抗和卡培他濱聯(lián)合使用,治療此前已接受至少一次抗人表皮生長因子受體-2(HER2)療法的晚期無法切除或轉移性HER2陽性的乳腺癌成人患者,,包括發(fā)生腦轉移的患者,。Tukysa是一種靶向HER2的口服小分子酪氨酸激酶抑制劑(TKI),此前已獲得FDA授予的孤兒藥資格,、突破性藥物資格和優(yōu)先審查,。相比FDA目標行動日期提前了4個月獲批的Tukysa目前也在接受歐洲藥品管理局(EMA)的審查。 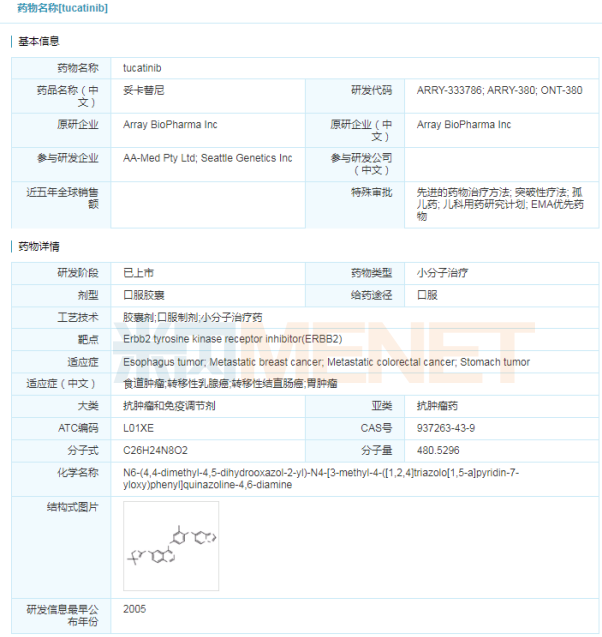 乳腺癌是著名的“女性殺手”,,發(fā)病率占據(jù)女性惡性腫瘤首位,。據(jù)統(tǒng)計,我國每年新增乳腺癌患者近30萬人左右,,其中HER2陽性占15%~25%,。此次批準得到名為 HER2CLIMB 的臨床試驗數(shù)據(jù)支持。數(shù)據(jù)表明,,與曲妥珠單抗+卡培他濱方案相比,,Tukysa三藥方案將疾病進展或死亡風險顯著降低了46%,顯著延長了無進展生存期、總生存期,,客觀緩解率提高將近一倍(40.6% vs 22.8%),,對于腦轉移患者中,Tukysa三藥方案同樣顯示優(yōu)秀的療效,。 Tukysa的活性藥物成分tucatinib,,這是一種口服生物有效的酪氨酸激酶抑制劑(TKI),對HER2具有高度選擇性,。HER2是治療乳腺癌的重要靶點,,雖然目前尚未有國產(chǎn)HER2抗體獲批,但HER2市場競爭激烈,,申報HER2抗體的企業(yè)已超過20家,,包括復宏漢霖、信達生物,、嘉和生物等,,廣度涉及單抗、雙抗,、ADC藥物,。 表3:國內(nèi)HER2靶點藥物研發(fā)情況(部分)
乳腺癌是著名的“女性殺手”,,發(fā)病率占據(jù)女性惡性腫瘤首位,。據(jù)統(tǒng)計,我國每年新增乳腺癌患者近30萬人左右,,其中HER2陽性占15%~25%,。此次批準得到名為 HER2CLIMB 的臨床試驗數(shù)據(jù)支持。數(shù)據(jù)表明,,與曲妥珠單抗+卡培他濱方案相比,,Tukysa三藥方案將疾病進展或死亡風險顯著降低了46%,顯著延長了無進展生存期、總生存期,,客觀緩解率提高將近一倍(40.6% vs 22.8%),,對于腦轉移患者中,Tukysa三藥方案同樣顯示優(yōu)秀的療效,。 Tukysa的活性藥物成分tucatinib,,這是一種口服生物有效的酪氨酸激酶抑制劑(TKI),對HER2具有高度選擇性,。HER2是治療乳腺癌的重要靶點,,雖然目前尚未有國產(chǎn)HER2抗體獲批,但HER2市場競爭激烈,,申報HER2抗體的企業(yè)已超過20家,,包括復宏漢霖、信達生物,、嘉和生物等,,廣度涉及單抗、雙抗,、ADC藥物,。 表3:國內(nèi)HER2靶點藥物研發(fā)情況(部分) ADC藥物持續(xù)火爆 Trodelvy(sacituzumab govitecan-hziy) 4月22日,美國FDA正式批準Immunomedics公司的抗體偶聯(lián)藥物(ADC)Trodelvy(sacituzumab govitecan-hziy),,用于治療至少接受過兩次轉移性疾病治療的三陰性乳腺癌成人患者,。Trodelvy是獲得FDA批準的首款治療三陰乳腺癌的抗體偶聯(lián)藥物,也是全球首個獲批的靶向人滋養(yǎng)層細胞表面抗原2(Trop-2)的抗體偶聯(lián)藥物,。此前,,F(xiàn)DA授予了Trodelvy突破性藥物資格、快速通道和優(yōu)先審查,。
ADC藥物持續(xù)火爆 Trodelvy(sacituzumab govitecan-hziy) 4月22日,美國FDA正式批準Immunomedics公司的抗體偶聯(lián)藥物(ADC)Trodelvy(sacituzumab govitecan-hziy),,用于治療至少接受過兩次轉移性疾病治療的三陰性乳腺癌成人患者,。Trodelvy是獲得FDA批準的首款治療三陰乳腺癌的抗體偶聯(lián)藥物,也是全球首個獲批的靶向人滋養(yǎng)層細胞表面抗原2(Trop-2)的抗體偶聯(lián)藥物,。此前,,F(xiàn)DA授予了Trodelvy突破性藥物資格、快速通道和優(yōu)先審查,。  三陰乳腺癌是乳腺癌的一種分型,,特指雌激素受體、孕激素受體以及人表皮生長因子受體均呈陰性的乳腺癌患者,,在乳腺癌學界有最難治且最“毒”分型的惡稱,。此次批準基于一項納入了108例既往至少接受過2種標準化療進展復發(fā)的晚期三陰乳癌患者的多中心、單臂的2期臨床試驗數(shù)據(jù),。結果表明,Trodelvy單藥治療整體緩解率為33.3%,,最佳臨床獲益率高達45.4%,,中位緩解持續(xù)時間為7.7個月,中位無進展生存期(PFS)為5.5個月,。更甚,,其三期ASCENT臨床試驗因結果數(shù)據(jù)驚艷,已在今年4月提前終止。 自從2019年美國FDA連續(xù)批出3款ADC藥物,,ADC打了場“翻身仗”,,如今已成為火爆全球的研究領域。至今,,包括sacituzumab govitecan在內(nèi),,全球已有9款ADC藥物獲批上市,恩美曲妥珠單抗(trastuzumab emtansine)作為首個ADC藥物今年1月在中國上市,,不少國內(nèi)藥企也紛紛布局,,其中研發(fā)進展最快的是百奧泰的BAT8001。 表4:已上市ADC藥物信息
三陰乳腺癌是乳腺癌的一種分型,,特指雌激素受體、孕激素受體以及人表皮生長因子受體均呈陰性的乳腺癌患者,,在乳腺癌學界有最難治且最“毒”分型的惡稱,。此次批準基于一項納入了108例既往至少接受過2種標準化療進展復發(fā)的晚期三陰乳癌患者的多中心、單臂的2期臨床試驗數(shù)據(jù),。結果表明,Trodelvy單藥治療整體緩解率為33.3%,,最佳臨床獲益率高達45.4%,,中位緩解持續(xù)時間為7.7個月,中位無進展生存期(PFS)為5.5個月,。更甚,,其三期ASCENT臨床試驗因結果數(shù)據(jù)驚艷,已在今年4月提前終止。 自從2019年美國FDA連續(xù)批出3款ADC藥物,,ADC打了場“翻身仗”,,如今已成為火爆全球的研究領域。至今,,包括sacituzumab govitecan在內(nèi),,全球已有9款ADC藥物獲批上市,恩美曲妥珠單抗(trastuzumab emtansine)作為首個ADC藥物今年1月在中國上市,,不少國內(nèi)藥企也紛紛布局,,其中研發(fā)進展最快的是百奧泰的BAT8001。 表4:已上市ADC藥物信息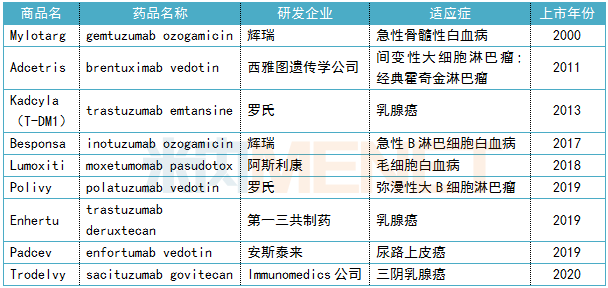 帕金森病又一新藥 Ongentys(opicapone) 近日,,Neurocrine Biosciences公司宣布,,美國FDA批準Ongentys(opicapone)作為左旋多巴/卡比多巴輔助治療藥物,治療經(jīng)歷“關閉”期的帕金森病患者,。Ongentys是首款獲得FDA批準的可減少“OFF”期時間且不會引起運動障礙的兒茶酚氧位甲基轉移酶(COMT)抑制劑,。該藥最早由BIAL Pharmaceuticals公司研究開發(fā),并于2016年6月在歐盟上市,。2017年Neurocrine Biosciences公司在BIAL Pharmaceuticals公司手中獲得美國和加拿大的獨家開發(fā)和商業(yè)化權利,;2018年,復星醫(yī)藥獲得opicapone在中國市場的獨家權利,。
帕金森病又一新藥 Ongentys(opicapone) 近日,,Neurocrine Biosciences公司宣布,,美國FDA批準Ongentys(opicapone)作為左旋多巴/卡比多巴輔助治療藥物,治療經(jīng)歷“關閉”期的帕金森病患者,。Ongentys是首款獲得FDA批準的可減少“OFF”期時間且不會引起運動障礙的兒茶酚氧位甲基轉移酶(COMT)抑制劑,。該藥最早由BIAL Pharmaceuticals公司研究開發(fā),并于2016年6月在歐盟上市,。2017年Neurocrine Biosciences公司在BIAL Pharmaceuticals公司手中獲得美國和加拿大的獨家開發(fā)和商業(yè)化權利,;2018年,復星醫(yī)藥獲得opicapone在中國市場的獨家權利,。 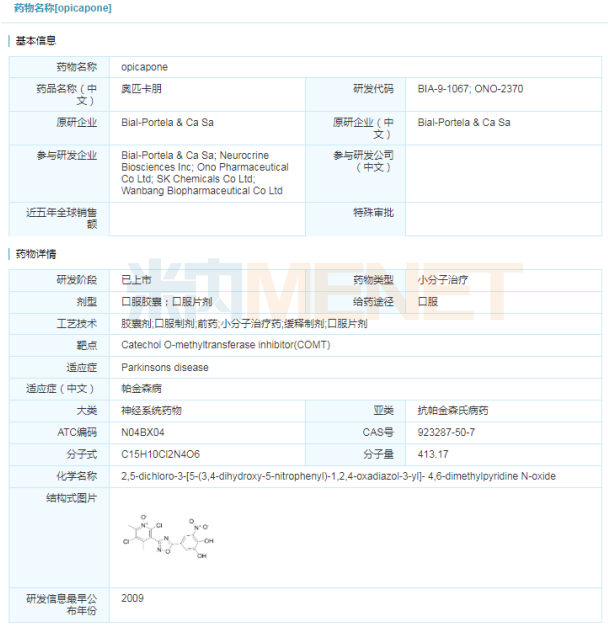 帕金森病是常見的神經(jīng)系統(tǒng)疾病,,目前尚未徹底治愈的方法。左旋多巴是治療帕金森b病最常見有效的藥物,,但是,,隨時間推移與病情的發(fā)展,左旋多巴的最佳作用不能發(fā)揮,,會導致PD癥狀(運動和非運動)重新出現(xiàn),,這些時期被稱為“OFF”期。“OFF”期PD運動癥狀增加,,如震顫,、運動減慢和行走困難,會擾亂患者進行日?;顒拥哪芰?,而Ongentys可以有效延緩“OFF”事件的出現(xiàn)。 Ongentys的有效性和安全性在大量臨床試驗數(shù)據(jù)中得到驗證,,其中BIPARK-1和BIPARK-2兩項3期臨床試驗數(shù)據(jù)均表明,,與安慰劑相比,患者接受50mg Ongentys治療后顯著減少了從基線到第14/15周的“OFF”時間,。與安慰劑組相比,,從基線到第14/15周,,患者無運動障礙的“ON”時間也有所增加。 資料來源:FDA官網(wǎng),、企業(yè)公告,、米內(nèi)網(wǎng)數(shù)據(jù)庫 注:如有錯漏,敬請指正
帕金森病是常見的神經(jīng)系統(tǒng)疾病,,目前尚未徹底治愈的方法。左旋多巴是治療帕金森b病最常見有效的藥物,,但是,,隨時間推移與病情的發(fā)展,左旋多巴的最佳作用不能發(fā)揮,,會導致PD癥狀(運動和非運動)重新出現(xiàn),,這些時期被稱為“OFF”期。“OFF”期PD運動癥狀增加,,如震顫,、運動減慢和行走困難,會擾亂患者進行日?;顒拥哪芰?,而Ongentys可以有效延緩“OFF”事件的出現(xiàn)。 Ongentys的有效性和安全性在大量臨床試驗數(shù)據(jù)中得到驗證,,其中BIPARK-1和BIPARK-2兩項3期臨床試驗數(shù)據(jù)均表明,,與安慰劑相比,患者接受50mg Ongentys治療后顯著減少了從基線到第14/15周的“OFF”時間,。與安慰劑組相比,,從基線到第14/15周,,患者無運動障礙的“ON”時間也有所增加。 資料來源:FDA官網(wǎng),、企業(yè)公告,、米內(nèi)網(wǎng)數(shù)據(jù)庫 注:如有錯漏,敬請指正
 2020年4月,,美國FDA批準5款創(chuàng)新藥,,其中包括治療1型神經(jīng)纖維瘤病的Koselugo、治療膽管癌的Pemazyre,、治療HER2陽性乳腺癌的Tukysa,、治療三陰乳腺癌的Trodelvy,以及治療帕金森病的Ongentys,。獲批上市的新藥含金量極重,,囊括多個突破性療法、多個首款,。 全球藥物研發(fā)市場的趨勢風口,,在4月獲批的新藥上表現(xiàn)得淋漓盡致。一方面生物藥是目前全球最具投資價值的醫(yī)藥細分領域,。憑借生物藥卓越的療效,,2019年全球最暢銷10款藥物中有7款是生物藥,排在榜首的是“藥王”阿達木單抗,。4月批準的創(chuàng)新藥有4款是生物藥,,包括3款單抗和1款ADC藥物,可謂相當亮眼,。另一方面腫瘤藥市場火熱依舊,。腫瘤因為發(fā)病機制的迥異,且患者人群龐大,,是各大研發(fā)企業(yè)競相角逐的大蛋糕,。4月批準的創(chuàng)新藥中抗腫瘤藥占80%,無論是罕見瘤種1型神經(jīng)纖維瘤病,、膽管癌,,還是高發(fā)瘤種乳腺癌,讓患者擁有新希望,。 表1:FDA批準新藥的詳細信息
2020年4月,,美國FDA批準5款創(chuàng)新藥,,其中包括治療1型神經(jīng)纖維瘤病的Koselugo、治療膽管癌的Pemazyre,、治療HER2陽性乳腺癌的Tukysa,、治療三陰乳腺癌的Trodelvy,以及治療帕金森病的Ongentys,。獲批上市的新藥含金量極重,,囊括多個突破性療法、多個首款,。 全球藥物研發(fā)市場的趨勢風口,,在4月獲批的新藥上表現(xiàn)得淋漓盡致。一方面生物藥是目前全球最具投資價值的醫(yī)藥細分領域,。憑借生物藥卓越的療效,,2019年全球最暢銷10款藥物中有7款是生物藥,排在榜首的是“藥王”阿達木單抗,。4月批準的創(chuàng)新藥有4款是生物藥,,包括3款單抗和1款ADC藥物,可謂相當亮眼,。另一方面腫瘤藥市場火熱依舊,。腫瘤因為發(fā)病機制的迥異,且患者人群龐大,,是各大研發(fā)企業(yè)競相角逐的大蛋糕,。4月批準的創(chuàng)新藥中抗腫瘤藥占80%,無論是罕見瘤種1型神經(jīng)纖維瘤病,、膽管癌,,還是高發(fā)瘤種乳腺癌,讓患者擁有新希望,。 表1:FDA批準新藥的詳細信息 零的突破 Koselugo(selumetinib) 4月10日,,美國FDA批準阿斯利康的激酶抑制劑Koselugo(selumetinib)上市,用于2歲及2歲以上患有1型神經(jīng)纖維瘤病(NF1)的兒童治療癥狀性,、無法手術切除的叢狀神經(jīng)纖維瘤(PN),。Koselugo是1型神經(jīng)纖維瘤病領域的突破,成為首款獲得FDA批準用于治療該病的藥物,。此前,,Koselugo已獲得FDA授予的孤兒藥資格、罕見兒科疾病用藥,、突破性療法認定和優(yōu)先審評資格等資格認定,。目前,該藥也已向歐洲藥品管理局(EMA)提交了上市申請,。
零的突破 Koselugo(selumetinib) 4月10日,,美國FDA批準阿斯利康的激酶抑制劑Koselugo(selumetinib)上市,用于2歲及2歲以上患有1型神經(jīng)纖維瘤病(NF1)的兒童治療癥狀性,、無法手術切除的叢狀神經(jīng)纖維瘤(PN),。Koselugo是1型神經(jīng)纖維瘤病領域的突破,成為首款獲得FDA批準用于治療該病的藥物,。此前,,Koselugo已獲得FDA授予的孤兒藥資格、罕見兒科疾病用藥,、突破性療法認定和優(yōu)先審評資格等資格認定,。目前,該藥也已向歐洲藥品管理局(EMA)提交了上市申請,。  1型神經(jīng)纖維瘤病是一種罕見的,、令人衰弱的遺傳病,大約3000~4000個新生兒就有1個患病,。30%-50%左右的1型神經(jīng)纖維瘤病患者神經(jīng)鞘內(nèi)會生長叢狀神經(jīng)纖維瘤,。這些叢狀神經(jīng)纖維瘤可引起很多臨床問題,如疼痛,、運動障礙,、氣道功能障礙、腸/膀胱功能障礙和畸形,。此次批準主要基于美國國家癌癥研究所的一項臨床試驗,。試驗結果表明,Koselugo作為口服單藥治療的總緩解率(ORR)達66%(50例患者中有33例確診為部分緩解),,這些患者中,,82%的患者緩解持續(xù)時間達到了12個月或更長。 Koselugo的活性成分selumetinib是一款選擇性MEK1/2激酶抑制劑,,MEK是RAS/MAPK信號通路中的關鍵蛋白激酶,而NF1的發(fā)病正是由于NF1基因突變擾亂了RAS/MAPK信號通路所導致的腫瘤生長,。目前,,由阿斯利康申報的selumetinib膠囊已獲得我國臨床默示許可,用于3歲及3歲以上兒童和青少年患有癥狀性和/或進展性,、無法手術的1型神經(jīng)纖維瘤相關叢狀神經(jīng)纖維瘤治療,。 表2:selumetinib膠囊獲批臨床信息
1型神經(jīng)纖維瘤病是一種罕見的,、令人衰弱的遺傳病,大約3000~4000個新生兒就有1個患病,。30%-50%左右的1型神經(jīng)纖維瘤病患者神經(jīng)鞘內(nèi)會生長叢狀神經(jīng)纖維瘤,。這些叢狀神經(jīng)纖維瘤可引起很多臨床問題,如疼痛,、運動障礙,、氣道功能障礙、腸/膀胱功能障礙和畸形,。此次批準主要基于美國國家癌癥研究所的一項臨床試驗,。試驗結果表明,Koselugo作為口服單藥治療的總緩解率(ORR)達66%(50例患者中有33例確診為部分緩解),,這些患者中,,82%的患者緩解持續(xù)時間達到了12個月或更長。 Koselugo的活性成分selumetinib是一款選擇性MEK1/2激酶抑制劑,,MEK是RAS/MAPK信號通路中的關鍵蛋白激酶,而NF1的發(fā)病正是由于NF1基因突變擾亂了RAS/MAPK信號通路所導致的腫瘤生長,。目前,,由阿斯利康申報的selumetinib膠囊已獲得我國臨床默示許可,用于3歲及3歲以上兒童和青少年患有癥狀性和/或進展性,、無法手術的1型神經(jīng)纖維瘤相關叢狀神經(jīng)纖維瘤治療,。 表2:selumetinib膠囊獲批臨床信息 信達再下一城 Pemazyre(pemigatinib) 4月20日,信達生物宣布,,美國FDA加速批準其合作伙伴Incyte公司靶向抗癌藥Pemazyre(pemigatinib)上市,,用于治療既往接受過治療、采用FDA批準方法檢測的具有FGFR2基因融合或其他重排且不可手術切除的局部晚期或轉移性膽管癌成人患者,。Pemazyre沖膽管癌傳統(tǒng)治療的困境,,是首款獲得批準用于治療膽管癌的靶向藥物。此前,Pemazyre已獲得FDA授予的突破新療法,、孤兒藥,、優(yōu)先審批等多項資格認定。
信達再下一城 Pemazyre(pemigatinib) 4月20日,信達生物宣布,,美國FDA加速批準其合作伙伴Incyte公司靶向抗癌藥Pemazyre(pemigatinib)上市,,用于治療既往接受過治療、采用FDA批準方法檢測的具有FGFR2基因融合或其他重排且不可手術切除的局部晚期或轉移性膽管癌成人患者,。Pemazyre沖膽管癌傳統(tǒng)治療的困境,,是首款獲得批準用于治療膽管癌的靶向藥物。此前,Pemazyre已獲得FDA授予的突破新療法,、孤兒藥,、優(yōu)先審批等多項資格認定。  優(yōu)異的臨床試驗數(shù)據(jù)為Pemazyre獲批奠定堅實的基礎,。在一項名為FIGHT-202的國際多中心,、開放性、單臂2期臨床研究中,,Pemazyre治療存在FGFR2融合/重排患者的客觀緩解率達35.5%,,疾病控制率超過80%,且起效迅速,、作用持久,。Pemazyre為膽管癌患者帶來更高質(zhì)量生存的希望。 2018年末,,信達生物和Incyte公司就Incyte的3個臨床階段候選藥物達成了戰(zhàn)略合作,,包括pemigatinib、itacitinib和parsaclisib,。信達生物擁有以上3個藥物在中國(包括香港/澳門,、臺灣地區(qū))的開發(fā)和商業(yè)化權利。pemigatinib國內(nèi)已啟動2期臨床試驗,,信達生物在2020年3月宣布pemigatinib完成中國首例患者給藥,。 “女性殺手”組合藥 Tukysa(tucatinib) 4月18日,西雅圖遺傳學公司宣布,,其靶向抗癌藥Tukysa(tucatinib)獲得美國FDA批準,,與曲妥珠單抗和卡培他濱聯(lián)合使用,治療此前已接受至少一次抗人表皮生長因子受體-2(HER2)療法的晚期無法切除或轉移性HER2陽性的乳腺癌成人患者,,包括發(fā)生腦轉移的患者,。Tukysa是一種靶向HER2的口服小分子酪氨酸激酶抑制劑(TKI),此前已獲得FDA授予的孤兒藥資格,、突破性藥物資格和優(yōu)先審查,。相比FDA目標行動日期提前了4個月獲批的Tukysa目前也在接受歐洲藥品管理局(EMA)的審查。
優(yōu)異的臨床試驗數(shù)據(jù)為Pemazyre獲批奠定堅實的基礎,。在一項名為FIGHT-202的國際多中心,、開放性、單臂2期臨床研究中,,Pemazyre治療存在FGFR2融合/重排患者的客觀緩解率達35.5%,,疾病控制率超過80%,且起效迅速,、作用持久,。Pemazyre為膽管癌患者帶來更高質(zhì)量生存的希望。 2018年末,,信達生物和Incyte公司就Incyte的3個臨床階段候選藥物達成了戰(zhàn)略合作,,包括pemigatinib、itacitinib和parsaclisib,。信達生物擁有以上3個藥物在中國(包括香港/澳門,、臺灣地區(qū))的開發(fā)和商業(yè)化權利。pemigatinib國內(nèi)已啟動2期臨床試驗,,信達生物在2020年3月宣布pemigatinib完成中國首例患者給藥,。 “女性殺手”組合藥 Tukysa(tucatinib) 4月18日,西雅圖遺傳學公司宣布,,其靶向抗癌藥Tukysa(tucatinib)獲得美國FDA批準,,與曲妥珠單抗和卡培他濱聯(lián)合使用,治療此前已接受至少一次抗人表皮生長因子受體-2(HER2)療法的晚期無法切除或轉移性HER2陽性的乳腺癌成人患者,,包括發(fā)生腦轉移的患者,。Tukysa是一種靶向HER2的口服小分子酪氨酸激酶抑制劑(TKI),此前已獲得FDA授予的孤兒藥資格,、突破性藥物資格和優(yōu)先審查,。相比FDA目標行動日期提前了4個月獲批的Tukysa目前也在接受歐洲藥品管理局(EMA)的審查。  乳腺癌是著名的“女性殺手”,,發(fā)病率占據(jù)女性惡性腫瘤首位,。據(jù)統(tǒng)計,我國每年新增乳腺癌患者近30萬人左右,,其中HER2陽性占15%~25%,。此次批準得到名為 HER2CLIMB 的臨床試驗數(shù)據(jù)支持。數(shù)據(jù)表明,,與曲妥珠單抗+卡培他濱方案相比,,Tukysa三藥方案將疾病進展或死亡風險顯著降低了46%,顯著延長了無進展生存期、總生存期,,客觀緩解率提高將近一倍(40.6% vs 22.8%),,對于腦轉移患者中,Tukysa三藥方案同樣顯示優(yōu)秀的療效,。 Tukysa的活性藥物成分tucatinib,,這是一種口服生物有效的酪氨酸激酶抑制劑(TKI),對HER2具有高度選擇性,。HER2是治療乳腺癌的重要靶點,,雖然目前尚未有國產(chǎn)HER2抗體獲批,但HER2市場競爭激烈,,申報HER2抗體的企業(yè)已超過20家,,包括復宏漢霖、信達生物,、嘉和生物等,,廣度涉及單抗、雙抗,、ADC藥物,。 表3:國內(nèi)HER2靶點藥物研發(fā)情況(部分)
乳腺癌是著名的“女性殺手”,,發(fā)病率占據(jù)女性惡性腫瘤首位,。據(jù)統(tǒng)計,我國每年新增乳腺癌患者近30萬人左右,,其中HER2陽性占15%~25%,。此次批準得到名為 HER2CLIMB 的臨床試驗數(shù)據(jù)支持。數(shù)據(jù)表明,,與曲妥珠單抗+卡培他濱方案相比,,Tukysa三藥方案將疾病進展或死亡風險顯著降低了46%,顯著延長了無進展生存期、總生存期,,客觀緩解率提高將近一倍(40.6% vs 22.8%),,對于腦轉移患者中,Tukysa三藥方案同樣顯示優(yōu)秀的療效,。 Tukysa的活性藥物成分tucatinib,,這是一種口服生物有效的酪氨酸激酶抑制劑(TKI),對HER2具有高度選擇性,。HER2是治療乳腺癌的重要靶點,,雖然目前尚未有國產(chǎn)HER2抗體獲批,但HER2市場競爭激烈,,申報HER2抗體的企業(yè)已超過20家,,包括復宏漢霖、信達生物,、嘉和生物等,,廣度涉及單抗、雙抗,、ADC藥物,。 表3:國內(nèi)HER2靶點藥物研發(fā)情況(部分) ADC藥物持續(xù)火爆 Trodelvy(sacituzumab govitecan-hziy) 4月22日,美國FDA正式批準Immunomedics公司的抗體偶聯(lián)藥物(ADC)Trodelvy(sacituzumab govitecan-hziy),,用于治療至少接受過兩次轉移性疾病治療的三陰性乳腺癌成人患者,。Trodelvy是獲得FDA批準的首款治療三陰乳腺癌的抗體偶聯(lián)藥物,也是全球首個獲批的靶向人滋養(yǎng)層細胞表面抗原2(Trop-2)的抗體偶聯(lián)藥物,。此前,,F(xiàn)DA授予了Trodelvy突破性藥物資格、快速通道和優(yōu)先審查,。
ADC藥物持續(xù)火爆 Trodelvy(sacituzumab govitecan-hziy) 4月22日,美國FDA正式批準Immunomedics公司的抗體偶聯(lián)藥物(ADC)Trodelvy(sacituzumab govitecan-hziy),,用于治療至少接受過兩次轉移性疾病治療的三陰性乳腺癌成人患者,。Trodelvy是獲得FDA批準的首款治療三陰乳腺癌的抗體偶聯(lián)藥物,也是全球首個獲批的靶向人滋養(yǎng)層細胞表面抗原2(Trop-2)的抗體偶聯(lián)藥物,。此前,,F(xiàn)DA授予了Trodelvy突破性藥物資格、快速通道和優(yōu)先審查,。  三陰乳腺癌是乳腺癌的一種分型,,特指雌激素受體、孕激素受體以及人表皮生長因子受體均呈陰性的乳腺癌患者,,在乳腺癌學界有最難治且最“毒”分型的惡稱,。此次批準基于一項納入了108例既往至少接受過2種標準化療進展復發(fā)的晚期三陰乳癌患者的多中心、單臂的2期臨床試驗數(shù)據(jù),。結果表明,Trodelvy單藥治療整體緩解率為33.3%,,最佳臨床獲益率高達45.4%,,中位緩解持續(xù)時間為7.7個月,中位無進展生存期(PFS)為5.5個月,。更甚,,其三期ASCENT臨床試驗因結果數(shù)據(jù)驚艷,已在今年4月提前終止。 自從2019年美國FDA連續(xù)批出3款ADC藥物,,ADC打了場“翻身仗”,,如今已成為火爆全球的研究領域。至今,,包括sacituzumab govitecan在內(nèi),,全球已有9款ADC藥物獲批上市,恩美曲妥珠單抗(trastuzumab emtansine)作為首個ADC藥物今年1月在中國上市,,不少國內(nèi)藥企也紛紛布局,,其中研發(fā)進展最快的是百奧泰的BAT8001。 表4:已上市ADC藥物信息
三陰乳腺癌是乳腺癌的一種分型,,特指雌激素受體、孕激素受體以及人表皮生長因子受體均呈陰性的乳腺癌患者,,在乳腺癌學界有最難治且最“毒”分型的惡稱,。此次批準基于一項納入了108例既往至少接受過2種標準化療進展復發(fā)的晚期三陰乳癌患者的多中心、單臂的2期臨床試驗數(shù)據(jù),。結果表明,Trodelvy單藥治療整體緩解率為33.3%,,最佳臨床獲益率高達45.4%,,中位緩解持續(xù)時間為7.7個月,中位無進展生存期(PFS)為5.5個月,。更甚,,其三期ASCENT臨床試驗因結果數(shù)據(jù)驚艷,已在今年4月提前終止。 自從2019年美國FDA連續(xù)批出3款ADC藥物,,ADC打了場“翻身仗”,,如今已成為火爆全球的研究領域。至今,,包括sacituzumab govitecan在內(nèi),,全球已有9款ADC藥物獲批上市,恩美曲妥珠單抗(trastuzumab emtansine)作為首個ADC藥物今年1月在中國上市,,不少國內(nèi)藥企也紛紛布局,,其中研發(fā)進展最快的是百奧泰的BAT8001。 表4:已上市ADC藥物信息 帕金森病又一新藥 Ongentys(opicapone) 近日,,Neurocrine Biosciences公司宣布,,美國FDA批準Ongentys(opicapone)作為左旋多巴/卡比多巴輔助治療藥物,治療經(jīng)歷“關閉”期的帕金森病患者,。Ongentys是首款獲得FDA批準的可減少“OFF”期時間且不會引起運動障礙的兒茶酚氧位甲基轉移酶(COMT)抑制劑,。該藥最早由BIAL Pharmaceuticals公司研究開發(fā),并于2016年6月在歐盟上市,。2017年Neurocrine Biosciences公司在BIAL Pharmaceuticals公司手中獲得美國和加拿大的獨家開發(fā)和商業(yè)化權利,;2018年,復星醫(yī)藥獲得opicapone在中國市場的獨家權利,。
帕金森病又一新藥 Ongentys(opicapone) 近日,,Neurocrine Biosciences公司宣布,,美國FDA批準Ongentys(opicapone)作為左旋多巴/卡比多巴輔助治療藥物,治療經(jīng)歷“關閉”期的帕金森病患者,。Ongentys是首款獲得FDA批準的可減少“OFF”期時間且不會引起運動障礙的兒茶酚氧位甲基轉移酶(COMT)抑制劑,。該藥最早由BIAL Pharmaceuticals公司研究開發(fā),并于2016年6月在歐盟上市,。2017年Neurocrine Biosciences公司在BIAL Pharmaceuticals公司手中獲得美國和加拿大的獨家開發(fā)和商業(yè)化權利,;2018年,復星醫(yī)藥獲得opicapone在中國市場的獨家權利,。  帕金森病是常見的神經(jīng)系統(tǒng)疾病,,目前尚未徹底治愈的方法。左旋多巴是治療帕金森b病最常見有效的藥物,,但是,,隨時間推移與病情的發(fā)展,左旋多巴的最佳作用不能發(fā)揮,,會導致PD癥狀(運動和非運動)重新出現(xiàn),,這些時期被稱為“OFF”期。“OFF”期PD運動癥狀增加,,如震顫,、運動減慢和行走困難,會擾亂患者進行日?;顒拥哪芰?,而Ongentys可以有效延緩“OFF”事件的出現(xiàn)。 Ongentys的有效性和安全性在大量臨床試驗數(shù)據(jù)中得到驗證,,其中BIPARK-1和BIPARK-2兩項3期臨床試驗數(shù)據(jù)均表明,,與安慰劑相比,患者接受50mg Ongentys治療后顯著減少了從基線到第14/15周的“OFF”時間,。與安慰劑組相比,,從基線到第14/15周,,患者無運動障礙的“ON”時間也有所增加。 資料來源:FDA官網(wǎng),、企業(yè)公告,、米內(nèi)網(wǎng)數(shù)據(jù)庫 注:如有錯漏,敬請指正
帕金森病是常見的神經(jīng)系統(tǒng)疾病,,目前尚未徹底治愈的方法。左旋多巴是治療帕金森b病最常見有效的藥物,,但是,,隨時間推移與病情的發(fā)展,左旋多巴的最佳作用不能發(fā)揮,,會導致PD癥狀(運動和非運動)重新出現(xiàn),,這些時期被稱為“OFF”期。“OFF”期PD運動癥狀增加,,如震顫,、運動減慢和行走困難,會擾亂患者進行日?;顒拥哪芰?,而Ongentys可以有效延緩“OFF”事件的出現(xiàn)。 Ongentys的有效性和安全性在大量臨床試驗數(shù)據(jù)中得到驗證,,其中BIPARK-1和BIPARK-2兩項3期臨床試驗數(shù)據(jù)均表明,,與安慰劑相比,患者接受50mg Ongentys治療后顯著減少了從基線到第14/15周的“OFF”時間,。與安慰劑組相比,,從基線到第14/15周,,患者無運動障礙的“ON”時間也有所增加。 資料來源:FDA官網(wǎng),、企業(yè)公告,、米內(nèi)網(wǎng)數(shù)據(jù)庫 注:如有錯漏,敬請指正