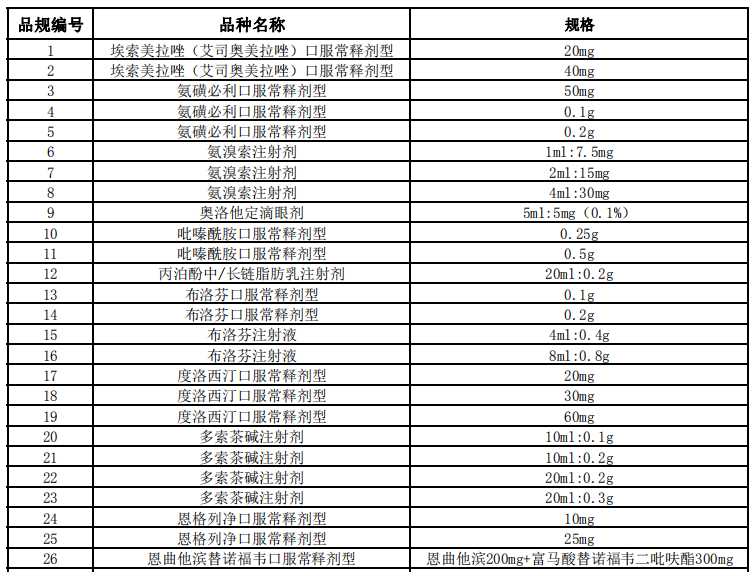
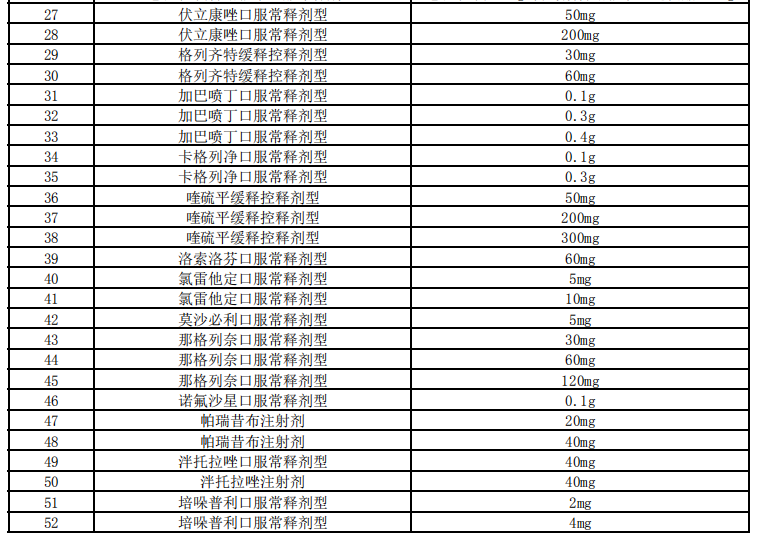
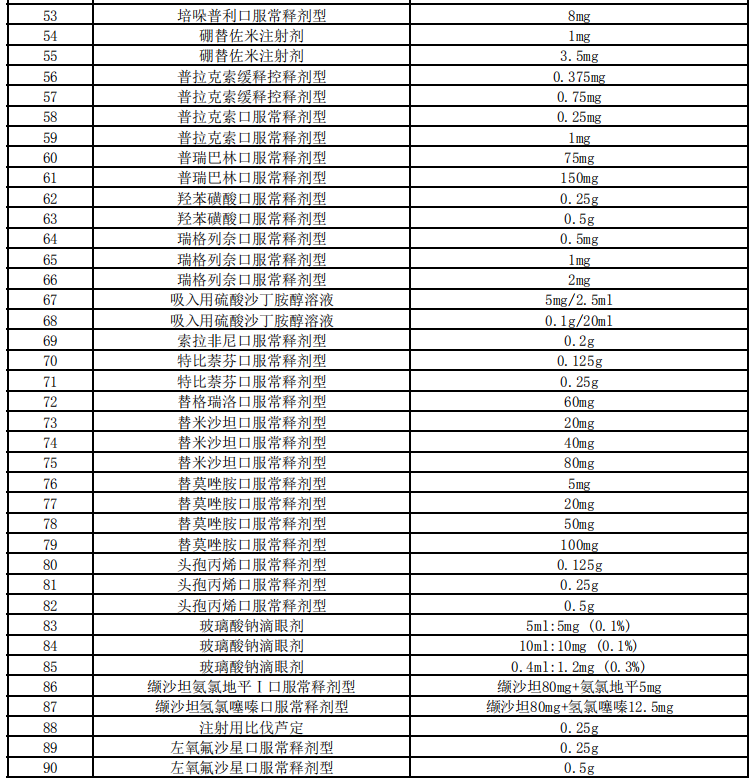
醫(yī)藥網(wǎng)12月28日訊 12月25日,,上海陽(yáng)光醫(yī)藥采購(gòu)網(wǎng)發(fā)布《關(guān)于開(kāi)展第四批國(guó)家組織藥品集中采購(gòu)相關(guān)藥品信息收集工作的通知》,第四批國(guó)家集采信息申報(bào)工作正式開(kāi)啟,。 以下為通知全文: 各藥品相關(guān)企業(yè): 為進(jìn)一步做好第四批國(guó)家組織藥品集中采購(gòu)工作,,優(yōu)化工作流程,建立常態(tài)化工作機(jī)制,,自2020年12月25日起,,聯(lián)合采購(gòu)辦公室開(kāi)展第四批國(guó)家組織藥品集中采購(gòu)相關(guān)信息申報(bào)工作,現(xiàn)將有關(guān)事項(xiàng)通知如下: 一,、藥品要求 屬于藥品申報(bào)范圍(詳見(jiàn)附件)并獲得國(guó)內(nèi)有效注冊(cè)批件的上市藥品,,且滿足以下要求之一: 1.原研藥及國(guó)家藥品監(jiān)督管理局發(fā)布的仿制藥質(zhì)量和療效一致性評(píng)價(jià)參比制劑。 2.通過(guò)國(guó)家藥品監(jiān)督管理局仿制藥質(zhì)量和療效一致性評(píng)價(jià)的仿制藥品,。 3.根據(jù)《國(guó)家食品藥品監(jiān)督管理總局關(guān)于發(fā)布化學(xué)藥品注冊(cè)分類改革工作方案的公告》〔2016年第51號(hào)〕,,按化學(xué)藥品新注冊(cè)分類批準(zhǔn)的仿制藥品。 4.納入《中國(guó)上市藥品目錄集》的藥品,。 二,、企業(yè)要求 屬于本次藥品申報(bào)范圍并滿足藥品要求的相關(guān)企業(yè),包括:提供藥品及伴隨服務(wù)的國(guó)內(nèi)藥品生產(chǎn)企業(yè),,藥品上市許可持有人,,境外生產(chǎn)企業(yè)在中國(guó)大陸設(shè)立或指定并能承擔(dān)相應(yīng)法律責(zé)任的代表機(jī)構(gòu)或企業(yè)法人。 三,、申報(bào)內(nèi)容 1.生產(chǎn)企業(yè),、藥品上市許可持有人,、境外生產(chǎn)企業(yè)在中國(guó)大陸設(shè)立或指定并能承擔(dān)相應(yīng)法律責(zé)任的代表機(jī)構(gòu)或企業(yè)法人(包括企業(yè)名稱、統(tǒng)一社會(huì)信用代碼,、聯(lián)系人,、授權(quán)書(shū)等)。 2.符合藥品要求的證明材料(包括藥品注冊(cè)批件,、補(bǔ)充注冊(cè)批件,、說(shuō)明書(shū)等)。 3.產(chǎn)能及原料藥自產(chǎn)說(shuō)明等,。 四,、注意事項(xiàng) 1.填報(bào)方式:請(qǐng)登陸“國(guó)家組織藥品集中采購(gòu)綜合服務(wù)平臺(tái)”(網(wǎng)址:http://pub.smpaa.cn/xxsj)進(jìn)行企業(yè)注冊(cè)及信息填報(bào)。新用戶需選擇“資質(zhì)維護(hù)用戶”身份進(jìn)行注冊(cè),;已有“資質(zhì)維護(hù)用戶”賬號(hào)的用戶,,賬號(hào)長(zhǎng)期有效不可重復(fù)注冊(cè)。 2.審核通過(guò)的藥品信息經(jīng)企業(yè)確認(rèn)將生成《申報(bào)信息一覽表》,,作為第四批國(guó)家組織藥品集中采購(gòu)的申報(bào)依據(jù),,請(qǐng)正確填寫(xiě)相關(guān)信息。具體要求以采購(gòu)文件規(guī)定為準(zhǔn),。 3.聯(lián)系方式:021-31773244,、31773255、31773266 ?。ǚ?wù)時(shí)間8:30-11:30,, 13:30-16:30;節(jié)假日除外) 特此通知,。 聯(lián)合采購(gòu)辦公室 2020年12月25日 附:藥品申報(bào)范圍