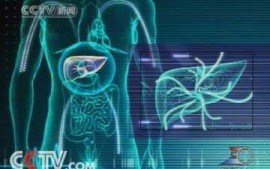
本報訊 (記者張巍?。锢韺W家組織網6月20日(北京時間)報道,多年來,,科學家一直依靠靜態(tài)的圖像來了解導致癌癥復發(fā)的關鍵蛋白?,F在,美國南方衛(wèi)理公會大學(SMU)的生物化學家另辟蹊徑,,為人體P糖蛋白(P-glycoprotein)構建了動態(tài)的三維計算機結構模型,,使其能更直觀地顯示P糖蛋白的工作原理,這有助于改進阻止癌癥復發(fā)的化學療法,。相關研究報告發(fā)表在《生物化學》雜志的網絡版上,。
P糖蛋白又被稱之為多藥耐藥性蛋白,很多化療藥物不起作用都與其有關,。P糖蛋白能夠自發(fā)地從細胞內吸出毒素,,但當癌癥細胞表達出比正常細胞更多的P糖蛋白時,化療藥物將不再有效,,因為P糖蛋白會把它當作毒素,,在其摧毀癌細胞之前將其抽出。
該校生物科學系的副教授約翰·懷斯表示:“我們正在找尋一些能臨時抑制抽吸作用的小分子,,一種能夠保持化療化合物存在直至其殺死癌細胞的安全,、有效的新藥?!?
科研人員通過進化關系和有關P糖蛋白組成的科學知識,,推斷出了人類P糖蛋白的結構。并利用計算機模型,,動態(tài)模擬展示了這種蛋白的抽吸動作,。他們基于囊括了2100萬可商購化合物的ZINC數據庫展開了模擬篩查,,其每天可借助SMU的高效計算機篩選大概4萬種化合物。懷斯等人還能在計算機中構建這些化合物分子,,并將溫度提升至37攝氏度以模擬人體環(huán)境,,或是保持適當的鹽分和其他適宜的環(huán)境等,就像在實際的實驗中一樣,,從而營造出可遵循物理定律和生物化學原理移動的三維模型,。借助這種方式,科學家能看到化合物如何與蛋白發(fā)生動態(tài)的相互作用,,而不僅僅是靜態(tài)的快照。
研究人員稱,,新的模型是一種功能強大的發(fā)現工具,,尤其是與高效的超級計算共同作用時效果更好。他們已經利用動態(tài)的三維模型篩選了超過800萬的潛在藥物化合物,,并對有希望成功制止化療失敗的幾百種進行了測試,。結果顯示,其中有少數化合物能夠抑制P糖蛋白的抽吸機制,。下一步,,他們還將回溯至三維計算機模型,繼續(xù)找尋類似的化合物,,但其最終是否能制成抗癌藥物仍有待檢驗,。
懷斯談到,這是一種良好的原理驗證,,在計算模型中運行化合物能夠快速,、經濟而有效地從大量化合物中篩選出可進行測試的藥物,這將為找到允許化療化合物進入體內并摧毀癌細胞的潛在新型藥物鋪平道路,。
總編輯圈點
盡管目前癌癥的治療方法層出不窮,,但化療仍舊是最常使用的療法之一?;煂δ[瘤有比較直接的抑制作用,,但它存在著“敵我不分”、有效劑量和中毒劑量非常接近,、毒副作用等嚴重不足,,這種“殺敵一千,自損八百”的療法往往使癌癥患者難以堅持完成整個療程,。而文中提到的新技術,,有望使這一現狀得到改觀,這對眾多癌癥患者來說,,無疑是天大的好消息,。唯愿新技術的應用能讓癌癥患者等得到。