潤寶醫(yī)療網(wǎng)3月22日訊 近日,,國家衛(wèi)健委等六部門正式公布了《第二批鼓勵仿制藥品目錄》,,再有17個品種被納入,截至目前,,兩批目錄合共收錄了50個品種(按通用名+劑型統(tǒng)計為56個產(chǎn)品),。據(jù)悉,被納入的品種為國內專利即將到期但尚未提出注冊申請,、臨床供應短缺或競爭不充分的藥品,,企業(yè)仿制相關藥品可獲得臨床試驗、關鍵共性技術研究,、優(yōu)先審評審批等方面支持,。米內網(wǎng)數(shù)據(jù)顯示,2019年國內仿制藥終端銷售額為10000多億元,,受帶量采購和重點監(jiān)控目錄政策影響,,仿制藥的增速持續(xù)放緩,,高端仿制藥入局后有望激發(fā)市場新活力。 鼓勵仿制出成效,!正大天晴領軍拿下“國內首家” 2019年6月《第一批鼓勵仿制藥品目錄建議清單》發(fā)布,,同年10月正式公布目錄名單,最終利匹韋林片被剔除,,33個品種成功入選,。2020年12月《第二批鼓勵仿制藥品目錄建議清單》發(fā)布,2021年3月正式公布名單,,溴莫尼定噻嗎洛爾滴眼劑以及奧拉帕利片被剔除,,最終17個品種成功入選。 表1:鼓勵仿制藥品中已有國產(chǎn)批文的產(chǎn)品情況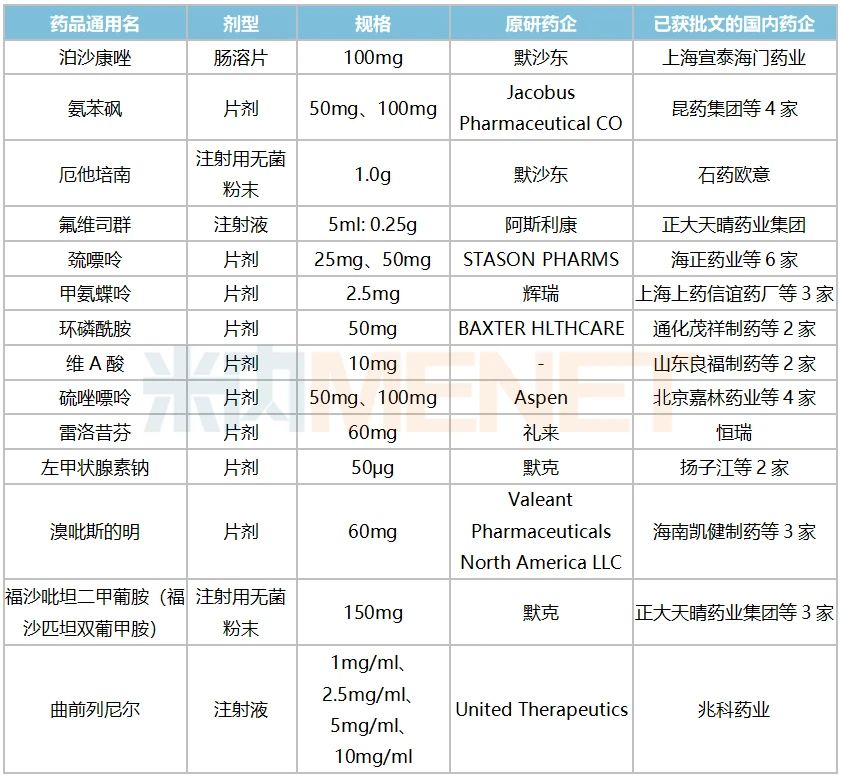 來源:米內網(wǎng)一鍵檢索 據(jù)統(tǒng)計,,鼓勵仿制的56個藥品中有14個已有國產(chǎn)批文,,得益于政策鼓勵,正大天晴藥業(yè)集團,、兆科藥業(yè),、上海宣泰海門藥業(yè)獲得了優(yōu)先審評的紅利,產(chǎn)品火速獲批上市,。 米內網(wǎng)數(shù)據(jù)顯示,,正大天晴藥業(yè)集團的注射用福沙匹坦雙葡甲胺在2015年9月申報3.1類新藥上市,2017年9月被納入優(yōu)先審評,,理由為“專利到期前1年的藥品生產(chǎn)申請”,,2019年10月獲批上市,成為該品種國內首家,。隨著豪森與齊魯陸續(xù)獲批,國內已有3家企業(yè)獲得批文,,山東羅欣藥業(yè)集團的3類仿制上市申請已在審評審批中,。 2020年,正大天晴藥業(yè)集團拿下了阿斯利康的重磅注射劑氟維司群的國內首仿,。原研產(chǎn)品2018年全球銷售額接超過10億美元,,2019年在中國城市公立醫(yī)院、縣級公立醫(yī)院,、城市社區(qū)中心及鄉(xiāng)鎮(zhèn)衛(wèi)生院(簡稱中國公立醫(yī)療機構)終端及中國城市實體藥店終端合計銷售額超過5億元,。正大天晴藥業(yè)集團于2019年1月申報4類仿制上市,2020年4月被納入優(yōu)先審評,,理由為“海外共線”,,同年8月獲批上市。目前豪森,、杭州九源基因工程的4類仿制上市申請在審評審批中,,在國產(chǎn)高端仿制藥的沖擊下,,阿斯利康的市場份額岌岌可危。 默沙東的泊沙康唑2018年全球賣出了7.4億美元,,目前已進口國內的劑型有口服混懸液,、腸溶片以及注射液。第一批鼓勵仿制目錄中,,注射液以及腸溶片被納入,,上海宣泰海門藥業(yè)于2019年2月提交泊沙康唑腸溶片4類仿制上市申請,同年9月被納入優(yōu)先審評,,理由為“海外共線”,,于2021年1月拿下國內首仿。四川科倫藥業(yè)的泊沙康唑腸溶片4類仿制上市申請正在審評審批中,,有望成為國內第二家,。目前,默沙東的腸溶片在國內市場銷售尚未放量,,國產(chǎn)高端仿制有望搶先發(fā)力,。 兆科藥業(yè)的曲前列尼爾注射液于2018年12月申報4類仿制上市,2019年6月被納入優(yōu)先審評,,理由為“罕見病用藥”,,2020年3月獲批首仿。曲前列尼爾是一款人工合成前列環(huán)素藥品,,可以促進血管舒張,,同時可抑制血小板的聚集,用于肺動脈高壓的癥狀治療,,該產(chǎn)品半衰期長,、藥物結構穩(wěn)定、使用方便,,作為一線治療和搶救藥物應用廣泛,。 此外,氨苯砜,、巰嘌呤,、甲氨蝶呤、環(huán)磷酰胺等品種目前雖有國產(chǎn)批文,,但尚無企業(yè)過評,,鼓勵企業(yè)研發(fā)并生產(chǎn)高端仿制藥,有利于提高該品種整體質量水平,。 10個首仿將來襲,,恒瑞、奧賽康……要沖刺 表2:暫無國產(chǎn)批文但仿制上市在審的產(chǎn)品情況
來源:米內網(wǎng)一鍵檢索 據(jù)統(tǒng)計,,鼓勵仿制的56個藥品中有14個已有國產(chǎn)批文,,得益于政策鼓勵,正大天晴藥業(yè)集團,、兆科藥業(yè),、上海宣泰海門藥業(yè)獲得了優(yōu)先審評的紅利,產(chǎn)品火速獲批上市,。 米內網(wǎng)數(shù)據(jù)顯示,,正大天晴藥業(yè)集團的注射用福沙匹坦雙葡甲胺在2015年9月申報3.1類新藥上市,2017年9月被納入優(yōu)先審評,,理由為“專利到期前1年的藥品生產(chǎn)申請”,,2019年10月獲批上市,成為該品種國內首家,。隨著豪森與齊魯陸續(xù)獲批,國內已有3家企業(yè)獲得批文,,山東羅欣藥業(yè)集團的3類仿制上市申請已在審評審批中,。 2020年,正大天晴藥業(yè)集團拿下了阿斯利康的重磅注射劑氟維司群的國內首仿,。原研產(chǎn)品2018年全球銷售額接超過10億美元,,2019年在中國城市公立醫(yī)院、縣級公立醫(yī)院,、城市社區(qū)中心及鄉(xiāng)鎮(zhèn)衛(wèi)生院(簡稱中國公立醫(yī)療機構)終端及中國城市實體藥店終端合計銷售額超過5億元,。正大天晴藥業(yè)集團于2019年1月申報4類仿制上市,2020年4月被納入優(yōu)先審評,,理由為“海外共線”,,同年8月獲批上市。目前豪森,、杭州九源基因工程的4類仿制上市申請在審評審批中,,在國產(chǎn)高端仿制藥的沖擊下,,阿斯利康的市場份額岌岌可危。 默沙東的泊沙康唑2018年全球賣出了7.4億美元,,目前已進口國內的劑型有口服混懸液,、腸溶片以及注射液。第一批鼓勵仿制目錄中,,注射液以及腸溶片被納入,,上海宣泰海門藥業(yè)于2019年2月提交泊沙康唑腸溶片4類仿制上市申請,同年9月被納入優(yōu)先審評,,理由為“海外共線”,,于2021年1月拿下國內首仿。四川科倫藥業(yè)的泊沙康唑腸溶片4類仿制上市申請正在審評審批中,,有望成為國內第二家,。目前,默沙東的腸溶片在國內市場銷售尚未放量,,國產(chǎn)高端仿制有望搶先發(fā)力,。 兆科藥業(yè)的曲前列尼爾注射液于2018年12月申報4類仿制上市,2019年6月被納入優(yōu)先審評,,理由為“罕見病用藥”,,2020年3月獲批首仿。曲前列尼爾是一款人工合成前列環(huán)素藥品,,可以促進血管舒張,,同時可抑制血小板的聚集,用于肺動脈高壓的癥狀治療,,該產(chǎn)品半衰期長,、藥物結構穩(wěn)定、使用方便,,作為一線治療和搶救藥物應用廣泛,。 此外,氨苯砜,、巰嘌呤,、甲氨蝶呤、環(huán)磷酰胺等品種目前雖有國產(chǎn)批文,,但尚無企業(yè)過評,,鼓勵企業(yè)研發(fā)并生產(chǎn)高端仿制藥,有利于提高該品種整體質量水平,。 10個首仿將來襲,,恒瑞、奧賽康……要沖刺 表2:暫無國產(chǎn)批文但仿制上市在審的產(chǎn)品情況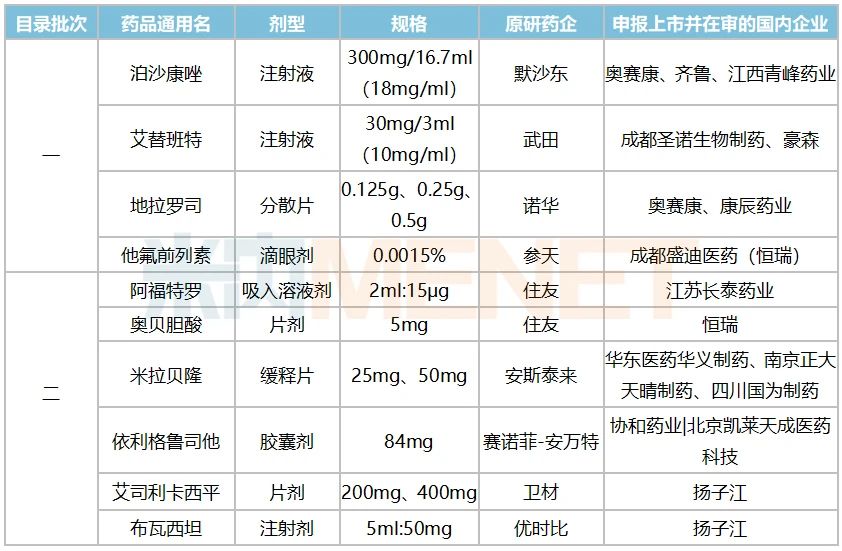 來源:米內網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 鼓勵仿制目錄中有10個產(chǎn)品即將迎來國內首仿,,默沙東,、諾華,、賽諾菲等跨國巨頭獨占國內市場的格局有望被打破。 前文提到,,泊沙康唑是默沙東的重磅品種,,注射液于2021年獲批進口。奧賽康于2018年8月申報泊沙康唑注射液3類仿制上市申請,,在2019年2月被納入優(yōu)先審評,,理由為“專利到期前1年的藥品生產(chǎn)申請”,目前受理號在審評審批中,,無論從申報時間還是政策鼓勵方面來看,,奧賽康拿下國內首仿的概率最大。齊魯與青峰藥業(yè)分別在2020年9月,、2021年1月申報3類仿制上市,,目前在審評審批中;先聲藥業(yè)|杭州澳亞生物技術于2021年2月申報4類仿制上市,,目前已獲受理,。 恒瑞子公司成都盛迪醫(yī)藥于2020年1月申報他氟前列素滴眼液4類仿制上市,同年5月被納入優(yōu)先審評,,理由為“臨床急需,、市場短缺藥品”。該產(chǎn)品是第一個不含防腐劑的前列腺素類似物滴眼液,,臨床上主要用于降低眼內壓升高的患者開角型青光眼或高眼壓癥,,現(xiàn)為全國醫(yī)保目錄談判品種。 米拉貝隆緩釋片被納入了第二批鼓勵仿制目錄,,原研藥企安斯泰來2019年全球賣出1616億日元(約為14.8億美元),,2017年獲批進入國內市場,2020年談判成功進入全國醫(yī)保目錄,。華東醫(yī)藥集團華義制藥于2019年10月申報4類仿制上市,,2020年3月被納入優(yōu)先審評,理由為“專利到期前1年的藥品生產(chǎn)申請”,。目前,南京正大天晴制藥和四川國為制藥分別于2020年9月,、2021年1月申報4類仿制上市的受理號正在審評審批中,。 依利格魯司他膠囊是賽諾菲-安萬特的重磅孤兒藥,2019年全球銷售額達2.1億歐元(約2.5億美元),,目前原研產(chǎn)品尚未獲批進口,。協(xié)和藥業(yè)|北京凱萊天成醫(yī)藥科技于2019年4月申報3類仿制上市,隨后被納入優(yōu)先審評,,理由為“罕見病藥品”,,目前暫無其他企業(yè)申報上市,。 賽諾菲、強生重磅產(chǎn)品遭哄搶,,科倫,、青峰……沖在最前線 表3:暫無國產(chǎn)批文、暫無企業(yè)申報上市但已有企業(yè)獲批臨床的產(chǎn)品
來源:米內網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 鼓勵仿制目錄中有10個產(chǎn)品即將迎來國內首仿,,默沙東,、諾華,、賽諾菲等跨國巨頭獨占國內市場的格局有望被打破。 前文提到,,泊沙康唑是默沙東的重磅品種,,注射液于2021年獲批進口。奧賽康于2018年8月申報泊沙康唑注射液3類仿制上市申請,,在2019年2月被納入優(yōu)先審評,,理由為“專利到期前1年的藥品生產(chǎn)申請”,目前受理號在審評審批中,,無論從申報時間還是政策鼓勵方面來看,,奧賽康拿下國內首仿的概率最大。齊魯與青峰藥業(yè)分別在2020年9月,、2021年1月申報3類仿制上市,,目前在審評審批中;先聲藥業(yè)|杭州澳亞生物技術于2021年2月申報4類仿制上市,,目前已獲受理,。 恒瑞子公司成都盛迪醫(yī)藥于2020年1月申報他氟前列素滴眼液4類仿制上市,同年5月被納入優(yōu)先審評,,理由為“臨床急需,、市場短缺藥品”。該產(chǎn)品是第一個不含防腐劑的前列腺素類似物滴眼液,,臨床上主要用于降低眼內壓升高的患者開角型青光眼或高眼壓癥,,現(xiàn)為全國醫(yī)保目錄談判品種。 米拉貝隆緩釋片被納入了第二批鼓勵仿制目錄,,原研藥企安斯泰來2019年全球賣出1616億日元(約為14.8億美元),,2017年獲批進入國內市場,2020年談判成功進入全國醫(yī)保目錄,。華東醫(yī)藥集團華義制藥于2019年10月申報4類仿制上市,,2020年3月被納入優(yōu)先審評,理由為“專利到期前1年的藥品生產(chǎn)申請”,。目前,南京正大天晴制藥和四川國為制藥分別于2020年9月,、2021年1月申報4類仿制上市的受理號正在審評審批中,。 依利格魯司他膠囊是賽諾菲-安萬特的重磅孤兒藥,2019年全球銷售額達2.1億歐元(約2.5億美元),,目前原研產(chǎn)品尚未獲批進口,。協(xié)和藥業(yè)|北京凱萊天成醫(yī)藥科技于2019年4月申報3類仿制上市,隨后被納入優(yōu)先審評,,理由為“罕見病藥品”,,目前暫無其他企業(yè)申報上市,。 賽諾菲、強生重磅產(chǎn)品遭哄搶,,科倫,、青峰……沖在最前線 表3:暫無國產(chǎn)批文、暫無企業(yè)申報上市但已有企業(yè)獲批臨床的產(chǎn)品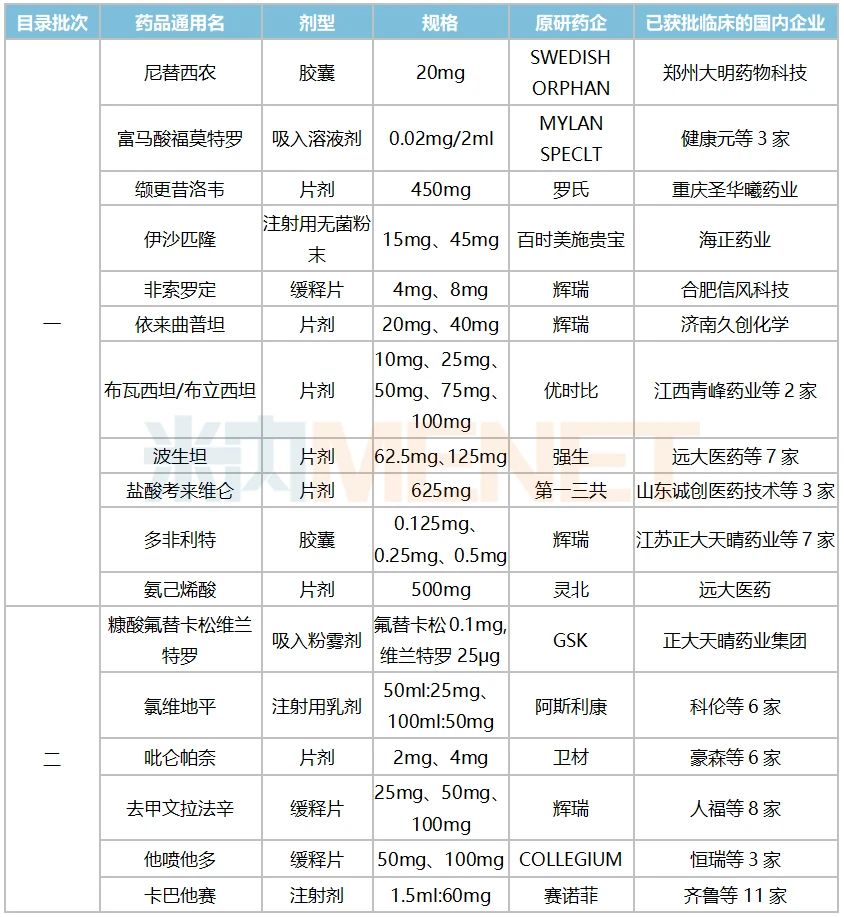 來源:米內網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 鼓勵仿制目錄中還有32個產(chǎn)品目前暫無國產(chǎn)批文也無企業(yè)申報上市,,這些產(chǎn)品有17個已有企業(yè)獲批臨床,,其中賽諾菲的卡巴他賽、輝瑞的去甲文拉法辛,、多非利特以及強生的波生坦最火熱,,獲批臨床的國內藥企數(shù)量達7家以上。 卡巴他賽是新一代半合成的紫杉烷類藥物,,多項體內外研究顯示其具有良好的抗腫瘤效果,,賽諾菲于2010年獲FDA批準上市,2018年全球銷售額突破4億歐元,,2020年創(chuàng)出新高,,達5.4億歐元。 圖1:科倫的卡巴他賽注射液最新臨床進展
來源:米內網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 鼓勵仿制目錄中還有32個產(chǎn)品目前暫無國產(chǎn)批文也無企業(yè)申報上市,,這些產(chǎn)品有17個已有企業(yè)獲批臨床,,其中賽諾菲的卡巴他賽、輝瑞的去甲文拉法辛,、多非利特以及強生的波生坦最火熱,,獲批臨床的國內藥企數(shù)量達7家以上。 卡巴他賽是新一代半合成的紫杉烷類藥物,,多項體內外研究顯示其具有良好的抗腫瘤效果,,賽諾菲于2010年獲FDA批準上市,2018年全球銷售額突破4億歐元,,2020年創(chuàng)出新高,,達5.4億歐元。 圖1:科倫的卡巴他賽注射液最新臨床進展 來源:米內網(wǎng)中國藥品臨床試驗公示庫 目前,,國內共有11家藥企申報了卡巴他賽注射液3.1類新藥臨床申請并已獲批,,四川科倫藥物研究院最早于2015年拿到臨床批件,目前最新進展是晚期實體瘤I期臨床已完成,,涉及胃癌或胃食管結合部腺癌的相關試驗正在進行中,。 強生的波生坦是一種特異性、競爭性的雙重內皮素受體拮抗劑,,可以通過降低肺和全身血管阻力,,從而在不增加心率的情況下增加心臟輸出量,改善特發(fā)性肺動脈高壓(PAH)患者的運動能力和血流動力學指標,,2001年被FDA批準在美國上市,,2018年全球銷售額超過5億美元。原研藥于2006年獲批進入國內市場,,目前獲批進口的劑型有片劑和分散片,,分別于2019年、2020年通過談判成功進入全國醫(yī)保目錄,,2019年在中國公立醫(yī)療機構終端及中國城市實體藥店終端該品種合計銷售額超過1億元,。 圖2:浙江醫(yī)藥新昌制藥廠的波生坦片最新臨床進展
來源:米內網(wǎng)中國藥品臨床試驗公示庫 目前,,國內共有11家藥企申報了卡巴他賽注射液3.1類新藥臨床申請并已獲批,,四川科倫藥物研究院最早于2015年拿到臨床批件,目前最新進展是晚期實體瘤I期臨床已完成,,涉及胃癌或胃食管結合部腺癌的相關試驗正在進行中,。 強生的波生坦是一種特異性、競爭性的雙重內皮素受體拮抗劑,,可以通過降低肺和全身血管阻力,,從而在不增加心率的情況下增加心臟輸出量,改善特發(fā)性肺動脈高壓(PAH)患者的運動能力和血流動力學指標,,2001年被FDA批準在美國上市,,2018年全球銷售額超過5億美元。原研藥于2006年獲批進入國內市場,,目前獲批進口的劑型有片劑和分散片,,分別于2019年、2020年通過談判成功進入全國醫(yī)保目錄,,2019年在中國公立醫(yī)療機構終端及中國城市實體藥店終端該品種合計銷售額超過1億元,。 圖2:浙江醫(yī)藥新昌制藥廠的波生坦片最新臨床進展 來源:米內網(wǎng)中國藥品臨床試驗公示庫 波生坦片被納入第一批鼓勵仿制目錄,目前國內已有7家藥企申報6類仿制上市獲批臨床,,其中浙江醫(yī)藥新昌制藥廠最早于2014年拿到臨床批件,,用于治療WHO III級和IV級原發(fā)性肺高壓病人的肺動脈高壓或者硬皮病引起的肺高壓的生物等效性試驗已完成。 吡侖帕奈是衛(wèi)材的抗癲癇新藥,于2012年首次獲得FDA批準用于12歲以上癲癇患者部分性發(fā)作的輔助治療,,無論患者是否伴有繼發(fā)性全面發(fā)作,,該品種2019年全球銷售額已達253億日元(約2.3億美元)。原研藥于2019年獲批進入中國市場,,2020年談判成功進入全國醫(yī)保目錄,。 圖3:南京華威醫(yī)藥科技的吡侖帕奈片最新臨床進展
來源:米內網(wǎng)中國藥品臨床試驗公示庫 波生坦片被納入第一批鼓勵仿制目錄,目前國內已有7家藥企申報6類仿制上市獲批臨床,,其中浙江醫(yī)藥新昌制藥廠最早于2014年拿到臨床批件,,用于治療WHO III級和IV級原發(fā)性肺高壓病人的肺動脈高壓或者硬皮病引起的肺高壓的生物等效性試驗已完成。 吡侖帕奈是衛(wèi)材的抗癲癇新藥,于2012年首次獲得FDA批準用于12歲以上癲癇患者部分性發(fā)作的輔助治療,,無論患者是否伴有繼發(fā)性全面發(fā)作,,該品種2019年全球銷售額已達253億日元(約2.3億美元)。原研藥于2019年獲批進入中國市場,,2020年談判成功進入全國醫(yī)保目錄,。 圖3:南京華威醫(yī)藥科技的吡侖帕奈片最新臨床進展 來源:米內網(wǎng)中國藥品臨床試驗公示庫 目前,國內共有6家藥企申報了吡侖帕奈片3.1類新藥臨床申請并已獲批,,南京華威醫(yī)藥科技于2016年拿到臨床批件,,目前最新進展是適用于4歲及以上部分性癲癇發(fā)作且伴有或不伴有繼發(fā)性全身大發(fā)作的癲癇病患者的輔助治療以及適用于12歲及以上癲癇患者原發(fā)性全面強直-陣攣癲癇發(fā)作的輔助治療的生物等效性試驗正在進行中。 優(yōu)時比的布瓦西坦(布立西坦)于2016年先后獲歐盟EMA及美國FDA批準上市,,作為其他藥物的附加治療用于治療16歲及以上癲癇患者的部分性發(fā)作,,2019年全球銷售額上漲至2.2億歐元。 圖4:布瓦西坦片的最新臨床進展
來源:米內網(wǎng)中國藥品臨床試驗公示庫 目前,國內共有6家藥企申報了吡侖帕奈片3.1類新藥臨床申請并已獲批,,南京華威醫(yī)藥科技于2016年拿到臨床批件,,目前最新進展是適用于4歲及以上部分性癲癇發(fā)作且伴有或不伴有繼發(fā)性全身大發(fā)作的癲癇病患者的輔助治療以及適用于12歲及以上癲癇患者原發(fā)性全面強直-陣攣癲癇發(fā)作的輔助治療的生物等效性試驗正在進行中。 優(yōu)時比的布瓦西坦(布立西坦)于2016年先后獲歐盟EMA及美國FDA批準上市,,作為其他藥物的附加治療用于治療16歲及以上癲癇患者的部分性發(fā)作,,2019年全球銷售額上漲至2.2億歐元。 圖4:布瓦西坦片的最新臨床進展 來源:米內網(wǎng)中國藥品臨床試驗公示庫 江西青峰藥業(yè)于2019年申報3類仿制上市獲批臨床,,目前最新進展是癲癇部分性發(fā)作輔助治療的生物等效性試驗已完成,,治療4歲及以上患者的部分性發(fā)作癲癇III期臨床正在進行中;杭州和澤醫(yī)藥科技|浙江京新藥業(yè)于2020年9月申報3類仿制臨床申請獲批,,目前最新進展是適用于治療4歲以上部分發(fā)作性癲癇的生物等效性試驗已完成,。 結語 鼓勵仿制藥目錄的出臺與擴容,旨在鼓勵更多的廠家去生產(chǎn),、競爭,,壓縮申報時間,優(yōu)化申報途徑,,在一定程度上緩解臨床必需,、療效確切、供應短缺藥品的供應,。其次,,近年來仿制藥一致性評價的開展,正改變著我國仿制藥行業(yè)長期以來“小,、亂,、散”的局面,集采常態(tài)化之下,,未來低壁壘仿制藥份額會緩慢下降,,高壁壘仿制藥份額將逐漸提升。目前,,兩批次鼓勵仿制藥品目錄中仍有15個產(chǎn)品暫無國內藥企涉足,,其中不乏羅氏、GSK,、艾伯維、諾和諾德等跨國藥企的最新產(chǎn)品,哪些國內藥企在未來會主動出擊,?我們將繼續(xù)跟蹤觀察,。 來源:中國政府網(wǎng)、米內網(wǎng)數(shù)據(jù)庫 審評數(shù)據(jù)統(tǒng)計截至3月19日,,如有錯漏,,敬請指正。
來源:米內網(wǎng)中國藥品臨床試驗公示庫 江西青峰藥業(yè)于2019年申報3類仿制上市獲批臨床,,目前最新進展是癲癇部分性發(fā)作輔助治療的生物等效性試驗已完成,,治療4歲及以上患者的部分性發(fā)作癲癇III期臨床正在進行中;杭州和澤醫(yī)藥科技|浙江京新藥業(yè)于2020年9月申報3類仿制臨床申請獲批,,目前最新進展是適用于治療4歲以上部分發(fā)作性癲癇的生物等效性試驗已完成,。 結語 鼓勵仿制藥目錄的出臺與擴容,旨在鼓勵更多的廠家去生產(chǎn),、競爭,,壓縮申報時間,優(yōu)化申報途徑,,在一定程度上緩解臨床必需,、療效確切、供應短缺藥品的供應,。其次,,近年來仿制藥一致性評價的開展,正改變著我國仿制藥行業(yè)長期以來“小,、亂,、散”的局面,集采常態(tài)化之下,,未來低壁壘仿制藥份額會緩慢下降,,高壁壘仿制藥份額將逐漸提升。目前,,兩批次鼓勵仿制藥品目錄中仍有15個產(chǎn)品暫無國內藥企涉足,,其中不乏羅氏、GSK,、艾伯維、諾和諾德等跨國藥企的最新產(chǎn)品,哪些國內藥企在未來會主動出擊,?我們將繼續(xù)跟蹤觀察,。 來源:中國政府網(wǎng)、米內網(wǎng)數(shù)據(jù)庫 審評數(shù)據(jù)統(tǒng)計截至3月19日,,如有錯漏,,敬請指正。
 來源:米內網(wǎng)一鍵檢索 據(jù)統(tǒng)計,,鼓勵仿制的56個藥品中有14個已有國產(chǎn)批文,,得益于政策鼓勵,正大天晴藥業(yè)集團,、兆科藥業(yè),、上海宣泰海門藥業(yè)獲得了優(yōu)先審評的紅利,產(chǎn)品火速獲批上市,。 米內網(wǎng)數(shù)據(jù)顯示,,正大天晴藥業(yè)集團的注射用福沙匹坦雙葡甲胺在2015年9月申報3.1類新藥上市,2017年9月被納入優(yōu)先審評,,理由為“專利到期前1年的藥品生產(chǎn)申請”,,2019年10月獲批上市,成為該品種國內首家,。隨著豪森與齊魯陸續(xù)獲批,國內已有3家企業(yè)獲得批文,,山東羅欣藥業(yè)集團的3類仿制上市申請已在審評審批中,。 2020年,正大天晴藥業(yè)集團拿下了阿斯利康的重磅注射劑氟維司群的國內首仿,。原研產(chǎn)品2018年全球銷售額接超過10億美元,,2019年在中國城市公立醫(yī)院、縣級公立醫(yī)院,、城市社區(qū)中心及鄉(xiāng)鎮(zhèn)衛(wèi)生院(簡稱中國公立醫(yī)療機構)終端及中國城市實體藥店終端合計銷售額超過5億元,。正大天晴藥業(yè)集團于2019年1月申報4類仿制上市,2020年4月被納入優(yōu)先審評,,理由為“海外共線”,,同年8月獲批上市。目前豪森,、杭州九源基因工程的4類仿制上市申請在審評審批中,,在國產(chǎn)高端仿制藥的沖擊下,,阿斯利康的市場份額岌岌可危。 默沙東的泊沙康唑2018年全球賣出了7.4億美元,,目前已進口國內的劑型有口服混懸液,、腸溶片以及注射液。第一批鼓勵仿制目錄中,,注射液以及腸溶片被納入,,上海宣泰海門藥業(yè)于2019年2月提交泊沙康唑腸溶片4類仿制上市申請,同年9月被納入優(yōu)先審評,,理由為“海外共線”,,于2021年1月拿下國內首仿。四川科倫藥業(yè)的泊沙康唑腸溶片4類仿制上市申請正在審評審批中,,有望成為國內第二家,。目前,默沙東的腸溶片在國內市場銷售尚未放量,,國產(chǎn)高端仿制有望搶先發(fā)力,。 兆科藥業(yè)的曲前列尼爾注射液于2018年12月申報4類仿制上市,2019年6月被納入優(yōu)先審評,,理由為“罕見病用藥”,,2020年3月獲批首仿。曲前列尼爾是一款人工合成前列環(huán)素藥品,,可以促進血管舒張,,同時可抑制血小板的聚集,用于肺動脈高壓的癥狀治療,,該產(chǎn)品半衰期長,、藥物結構穩(wěn)定、使用方便,,作為一線治療和搶救藥物應用廣泛,。 此外,氨苯砜,、巰嘌呤,、甲氨蝶呤、環(huán)磷酰胺等品種目前雖有國產(chǎn)批文,,但尚無企業(yè)過評,,鼓勵企業(yè)研發(fā)并生產(chǎn)高端仿制藥,有利于提高該品種整體質量水平,。 10個首仿將來襲,,恒瑞、奧賽康……要沖刺 表2:暫無國產(chǎn)批文但仿制上市在審的產(chǎn)品情況
來源:米內網(wǎng)一鍵檢索 據(jù)統(tǒng)計,,鼓勵仿制的56個藥品中有14個已有國產(chǎn)批文,,得益于政策鼓勵,正大天晴藥業(yè)集團,、兆科藥業(yè),、上海宣泰海門藥業(yè)獲得了優(yōu)先審評的紅利,產(chǎn)品火速獲批上市,。 米內網(wǎng)數(shù)據(jù)顯示,,正大天晴藥業(yè)集團的注射用福沙匹坦雙葡甲胺在2015年9月申報3.1類新藥上市,2017年9月被納入優(yōu)先審評,,理由為“專利到期前1年的藥品生產(chǎn)申請”,,2019年10月獲批上市,成為該品種國內首家,。隨著豪森與齊魯陸續(xù)獲批,國內已有3家企業(yè)獲得批文,,山東羅欣藥業(yè)集團的3類仿制上市申請已在審評審批中,。 2020年,正大天晴藥業(yè)集團拿下了阿斯利康的重磅注射劑氟維司群的國內首仿,。原研產(chǎn)品2018年全球銷售額接超過10億美元,,2019年在中國城市公立醫(yī)院、縣級公立醫(yī)院,、城市社區(qū)中心及鄉(xiāng)鎮(zhèn)衛(wèi)生院(簡稱中國公立醫(yī)療機構)終端及中國城市實體藥店終端合計銷售額超過5億元,。正大天晴藥業(yè)集團于2019年1月申報4類仿制上市,2020年4月被納入優(yōu)先審評,,理由為“海外共線”,,同年8月獲批上市。目前豪森,、杭州九源基因工程的4類仿制上市申請在審評審批中,,在國產(chǎn)高端仿制藥的沖擊下,,阿斯利康的市場份額岌岌可危。 默沙東的泊沙康唑2018年全球賣出了7.4億美元,,目前已進口國內的劑型有口服混懸液,、腸溶片以及注射液。第一批鼓勵仿制目錄中,,注射液以及腸溶片被納入,,上海宣泰海門藥業(yè)于2019年2月提交泊沙康唑腸溶片4類仿制上市申請,同年9月被納入優(yōu)先審評,,理由為“海外共線”,,于2021年1月拿下國內首仿。四川科倫藥業(yè)的泊沙康唑腸溶片4類仿制上市申請正在審評審批中,,有望成為國內第二家,。目前,默沙東的腸溶片在國內市場銷售尚未放量,,國產(chǎn)高端仿制有望搶先發(fā)力,。 兆科藥業(yè)的曲前列尼爾注射液于2018年12月申報4類仿制上市,2019年6月被納入優(yōu)先審評,,理由為“罕見病用藥”,,2020年3月獲批首仿。曲前列尼爾是一款人工合成前列環(huán)素藥品,,可以促進血管舒張,,同時可抑制血小板的聚集,用于肺動脈高壓的癥狀治療,,該產(chǎn)品半衰期長,、藥物結構穩(wěn)定、使用方便,,作為一線治療和搶救藥物應用廣泛,。 此外,氨苯砜,、巰嘌呤,、甲氨蝶呤、環(huán)磷酰胺等品種目前雖有國產(chǎn)批文,,但尚無企業(yè)過評,,鼓勵企業(yè)研發(fā)并生產(chǎn)高端仿制藥,有利于提高該品種整體質量水平,。 10個首仿將來襲,,恒瑞、奧賽康……要沖刺 表2:暫無國產(chǎn)批文但仿制上市在審的產(chǎn)品情況 來源:米內網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 鼓勵仿制目錄中有10個產(chǎn)品即將迎來國內首仿,,默沙東,、諾華,、賽諾菲等跨國巨頭獨占國內市場的格局有望被打破。 前文提到,,泊沙康唑是默沙東的重磅品種,,注射液于2021年獲批進口。奧賽康于2018年8月申報泊沙康唑注射液3類仿制上市申請,,在2019年2月被納入優(yōu)先審評,,理由為“專利到期前1年的藥品生產(chǎn)申請”,目前受理號在審評審批中,,無論從申報時間還是政策鼓勵方面來看,,奧賽康拿下國內首仿的概率最大。齊魯與青峰藥業(yè)分別在2020年9月,、2021年1月申報3類仿制上市,,目前在審評審批中;先聲藥業(yè)|杭州澳亞生物技術于2021年2月申報4類仿制上市,,目前已獲受理,。 恒瑞子公司成都盛迪醫(yī)藥于2020年1月申報他氟前列素滴眼液4類仿制上市,同年5月被納入優(yōu)先審評,,理由為“臨床急需,、市場短缺藥品”。該產(chǎn)品是第一個不含防腐劑的前列腺素類似物滴眼液,,臨床上主要用于降低眼內壓升高的患者開角型青光眼或高眼壓癥,,現(xiàn)為全國醫(yī)保目錄談判品種。 米拉貝隆緩釋片被納入了第二批鼓勵仿制目錄,,原研藥企安斯泰來2019年全球賣出1616億日元(約為14.8億美元),,2017年獲批進入國內市場,2020年談判成功進入全國醫(yī)保目錄,。華東醫(yī)藥集團華義制藥于2019年10月申報4類仿制上市,,2020年3月被納入優(yōu)先審評,理由為“專利到期前1年的藥品生產(chǎn)申請”,。目前,南京正大天晴制藥和四川國為制藥分別于2020年9月,、2021年1月申報4類仿制上市的受理號正在審評審批中,。 依利格魯司他膠囊是賽諾菲-安萬特的重磅孤兒藥,2019年全球銷售額達2.1億歐元(約2.5億美元),,目前原研產(chǎn)品尚未獲批進口,。協(xié)和藥業(yè)|北京凱萊天成醫(yī)藥科技于2019年4月申報3類仿制上市,隨后被納入優(yōu)先審評,,理由為“罕見病藥品”,,目前暫無其他企業(yè)申報上市,。 賽諾菲、強生重磅產(chǎn)品遭哄搶,,科倫,、青峰……沖在最前線 表3:暫無國產(chǎn)批文、暫無企業(yè)申報上市但已有企業(yè)獲批臨床的產(chǎn)品
來源:米內網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 鼓勵仿制目錄中有10個產(chǎn)品即將迎來國內首仿,,默沙東,、諾華,、賽諾菲等跨國巨頭獨占國內市場的格局有望被打破。 前文提到,,泊沙康唑是默沙東的重磅品種,,注射液于2021年獲批進口。奧賽康于2018年8月申報泊沙康唑注射液3類仿制上市申請,,在2019年2月被納入優(yōu)先審評,,理由為“專利到期前1年的藥品生產(chǎn)申請”,目前受理號在審評審批中,,無論從申報時間還是政策鼓勵方面來看,,奧賽康拿下國內首仿的概率最大。齊魯與青峰藥業(yè)分別在2020年9月,、2021年1月申報3類仿制上市,,目前在審評審批中;先聲藥業(yè)|杭州澳亞生物技術于2021年2月申報4類仿制上市,,目前已獲受理,。 恒瑞子公司成都盛迪醫(yī)藥于2020年1月申報他氟前列素滴眼液4類仿制上市,同年5月被納入優(yōu)先審評,,理由為“臨床急需,、市場短缺藥品”。該產(chǎn)品是第一個不含防腐劑的前列腺素類似物滴眼液,,臨床上主要用于降低眼內壓升高的患者開角型青光眼或高眼壓癥,,現(xiàn)為全國醫(yī)保目錄談判品種。 米拉貝隆緩釋片被納入了第二批鼓勵仿制目錄,,原研藥企安斯泰來2019年全球賣出1616億日元(約為14.8億美元),,2017年獲批進入國內市場,2020年談判成功進入全國醫(yī)保目錄,。華東醫(yī)藥集團華義制藥于2019年10月申報4類仿制上市,,2020年3月被納入優(yōu)先審評,理由為“專利到期前1年的藥品生產(chǎn)申請”,。目前,南京正大天晴制藥和四川國為制藥分別于2020年9月,、2021年1月申報4類仿制上市的受理號正在審評審批中,。 依利格魯司他膠囊是賽諾菲-安萬特的重磅孤兒藥,2019年全球銷售額達2.1億歐元(約2.5億美元),,目前原研產(chǎn)品尚未獲批進口,。協(xié)和藥業(yè)|北京凱萊天成醫(yī)藥科技于2019年4月申報3類仿制上市,隨后被納入優(yōu)先審評,,理由為“罕見病藥品”,,目前暫無其他企業(yè)申報上市,。 賽諾菲、強生重磅產(chǎn)品遭哄搶,,科倫,、青峰……沖在最前線 表3:暫無國產(chǎn)批文、暫無企業(yè)申報上市但已有企業(yè)獲批臨床的產(chǎn)品 來源:米內網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 鼓勵仿制目錄中還有32個產(chǎn)品目前暫無國產(chǎn)批文也無企業(yè)申報上市,,這些產(chǎn)品有17個已有企業(yè)獲批臨床,,其中賽諾菲的卡巴他賽、輝瑞的去甲文拉法辛,、多非利特以及強生的波生坦最火熱,,獲批臨床的國內藥企數(shù)量達7家以上。 卡巴他賽是新一代半合成的紫杉烷類藥物,,多項體內外研究顯示其具有良好的抗腫瘤效果,,賽諾菲于2010年獲FDA批準上市,2018年全球銷售額突破4億歐元,,2020年創(chuàng)出新高,,達5.4億歐元。 圖1:科倫的卡巴他賽注射液最新臨床進展
來源:米內網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫 鼓勵仿制目錄中還有32個產(chǎn)品目前暫無國產(chǎn)批文也無企業(yè)申報上市,,這些產(chǎn)品有17個已有企業(yè)獲批臨床,,其中賽諾菲的卡巴他賽、輝瑞的去甲文拉法辛,、多非利特以及強生的波生坦最火熱,,獲批臨床的國內藥企數(shù)量達7家以上。 卡巴他賽是新一代半合成的紫杉烷類藥物,,多項體內外研究顯示其具有良好的抗腫瘤效果,,賽諾菲于2010年獲FDA批準上市,2018年全球銷售額突破4億歐元,,2020年創(chuàng)出新高,,達5.4億歐元。 圖1:科倫的卡巴他賽注射液最新臨床進展 來源:米內網(wǎng)中國藥品臨床試驗公示庫 目前,,國內共有11家藥企申報了卡巴他賽注射液3.1類新藥臨床申請并已獲批,,四川科倫藥物研究院最早于2015年拿到臨床批件,目前最新進展是晚期實體瘤I期臨床已完成,,涉及胃癌或胃食管結合部腺癌的相關試驗正在進行中,。 強生的波生坦是一種特異性、競爭性的雙重內皮素受體拮抗劑,,可以通過降低肺和全身血管阻力,,從而在不增加心率的情況下增加心臟輸出量,改善特發(fā)性肺動脈高壓(PAH)患者的運動能力和血流動力學指標,,2001年被FDA批準在美國上市,,2018年全球銷售額超過5億美元。原研藥于2006年獲批進入國內市場,,目前獲批進口的劑型有片劑和分散片,,分別于2019年、2020年通過談判成功進入全國醫(yī)保目錄,,2019年在中國公立醫(yī)療機構終端及中國城市實體藥店終端該品種合計銷售額超過1億元,。 圖2:浙江醫(yī)藥新昌制藥廠的波生坦片最新臨床進展
來源:米內網(wǎng)中國藥品臨床試驗公示庫 目前,,國內共有11家藥企申報了卡巴他賽注射液3.1類新藥臨床申請并已獲批,,四川科倫藥物研究院最早于2015年拿到臨床批件,目前最新進展是晚期實體瘤I期臨床已完成,,涉及胃癌或胃食管結合部腺癌的相關試驗正在進行中,。 強生的波生坦是一種特異性、競爭性的雙重內皮素受體拮抗劑,,可以通過降低肺和全身血管阻力,,從而在不增加心率的情況下增加心臟輸出量,改善特發(fā)性肺動脈高壓(PAH)患者的運動能力和血流動力學指標,,2001年被FDA批準在美國上市,,2018年全球銷售額超過5億美元。原研藥于2006年獲批進入國內市場,,目前獲批進口的劑型有片劑和分散片,,分別于2019年、2020年通過談判成功進入全國醫(yī)保目錄,,2019年在中國公立醫(yī)療機構終端及中國城市實體藥店終端該品種合計銷售額超過1億元,。 圖2:浙江醫(yī)藥新昌制藥廠的波生坦片最新臨床進展 來源:米內網(wǎng)中國藥品臨床試驗公示庫 波生坦片被納入第一批鼓勵仿制目錄,目前國內已有7家藥企申報6類仿制上市獲批臨床,,其中浙江醫(yī)藥新昌制藥廠最早于2014年拿到臨床批件,,用于治療WHO III級和IV級原發(fā)性肺高壓病人的肺動脈高壓或者硬皮病引起的肺高壓的生物等效性試驗已完成。 吡侖帕奈是衛(wèi)材的抗癲癇新藥,于2012年首次獲得FDA批準用于12歲以上癲癇患者部分性發(fā)作的輔助治療,,無論患者是否伴有繼發(fā)性全面發(fā)作,,該品種2019年全球銷售額已達253億日元(約2.3億美元)。原研藥于2019年獲批進入中國市場,,2020年談判成功進入全國醫(yī)保目錄,。 圖3:南京華威醫(yī)藥科技的吡侖帕奈片最新臨床進展
來源:米內網(wǎng)中國藥品臨床試驗公示庫 波生坦片被納入第一批鼓勵仿制目錄,目前國內已有7家藥企申報6類仿制上市獲批臨床,,其中浙江醫(yī)藥新昌制藥廠最早于2014年拿到臨床批件,,用于治療WHO III級和IV級原發(fā)性肺高壓病人的肺動脈高壓或者硬皮病引起的肺高壓的生物等效性試驗已完成。 吡侖帕奈是衛(wèi)材的抗癲癇新藥,于2012年首次獲得FDA批準用于12歲以上癲癇患者部分性發(fā)作的輔助治療,,無論患者是否伴有繼發(fā)性全面發(fā)作,,該品種2019年全球銷售額已達253億日元(約2.3億美元)。原研藥于2019年獲批進入中國市場,,2020年談判成功進入全國醫(yī)保目錄,。 圖3:南京華威醫(yī)藥科技的吡侖帕奈片最新臨床進展 來源:米內網(wǎng)中國藥品臨床試驗公示庫 目前,國內共有6家藥企申報了吡侖帕奈片3.1類新藥臨床申請并已獲批,,南京華威醫(yī)藥科技于2016年拿到臨床批件,,目前最新進展是適用于4歲及以上部分性癲癇發(fā)作且伴有或不伴有繼發(fā)性全身大發(fā)作的癲癇病患者的輔助治療以及適用于12歲及以上癲癇患者原發(fā)性全面強直-陣攣癲癇發(fā)作的輔助治療的生物等效性試驗正在進行中。 優(yōu)時比的布瓦西坦(布立西坦)于2016年先后獲歐盟EMA及美國FDA批準上市,,作為其他藥物的附加治療用于治療16歲及以上癲癇患者的部分性發(fā)作,,2019年全球銷售額上漲至2.2億歐元。 圖4:布瓦西坦片的最新臨床進展
來源:米內網(wǎng)中國藥品臨床試驗公示庫 目前,國內共有6家藥企申報了吡侖帕奈片3.1類新藥臨床申請并已獲批,,南京華威醫(yī)藥科技于2016年拿到臨床批件,,目前最新進展是適用于4歲及以上部分性癲癇發(fā)作且伴有或不伴有繼發(fā)性全身大發(fā)作的癲癇病患者的輔助治療以及適用于12歲及以上癲癇患者原發(fā)性全面強直-陣攣癲癇發(fā)作的輔助治療的生物等效性試驗正在進行中。 優(yōu)時比的布瓦西坦(布立西坦)于2016年先后獲歐盟EMA及美國FDA批準上市,,作為其他藥物的附加治療用于治療16歲及以上癲癇患者的部分性發(fā)作,,2019年全球銷售額上漲至2.2億歐元。 圖4:布瓦西坦片的最新臨床進展 來源:米內網(wǎng)中國藥品臨床試驗公示庫 江西青峰藥業(yè)于2019年申報3類仿制上市獲批臨床,,目前最新進展是癲癇部分性發(fā)作輔助治療的生物等效性試驗已完成,,治療4歲及以上患者的部分性發(fā)作癲癇III期臨床正在進行中;杭州和澤醫(yī)藥科技|浙江京新藥業(yè)于2020年9月申報3類仿制臨床申請獲批,,目前最新進展是適用于治療4歲以上部分發(fā)作性癲癇的生物等效性試驗已完成,。 結語 鼓勵仿制藥目錄的出臺與擴容,旨在鼓勵更多的廠家去生產(chǎn),、競爭,,壓縮申報時間,優(yōu)化申報途徑,,在一定程度上緩解臨床必需,、療效確切、供應短缺藥品的供應,。其次,,近年來仿制藥一致性評價的開展,正改變著我國仿制藥行業(yè)長期以來“小,、亂,、散”的局面,集采常態(tài)化之下,,未來低壁壘仿制藥份額會緩慢下降,,高壁壘仿制藥份額將逐漸提升。目前,,兩批次鼓勵仿制藥品目錄中仍有15個產(chǎn)品暫無國內藥企涉足,,其中不乏羅氏、GSK,、艾伯維、諾和諾德等跨國藥企的最新產(chǎn)品,哪些國內藥企在未來會主動出擊,?我們將繼續(xù)跟蹤觀察,。 來源:中國政府網(wǎng)、米內網(wǎng)數(shù)據(jù)庫 審評數(shù)據(jù)統(tǒng)計截至3月19日,,如有錯漏,,敬請指正。
來源:米內網(wǎng)中國藥品臨床試驗公示庫 江西青峰藥業(yè)于2019年申報3類仿制上市獲批臨床,,目前最新進展是癲癇部分性發(fā)作輔助治療的生物等效性試驗已完成,,治療4歲及以上患者的部分性發(fā)作癲癇III期臨床正在進行中;杭州和澤醫(yī)藥科技|浙江京新藥業(yè)于2020年9月申報3類仿制臨床申請獲批,,目前最新進展是適用于治療4歲以上部分發(fā)作性癲癇的生物等效性試驗已完成,。 結語 鼓勵仿制藥目錄的出臺與擴容,旨在鼓勵更多的廠家去生產(chǎn),、競爭,,壓縮申報時間,優(yōu)化申報途徑,,在一定程度上緩解臨床必需,、療效確切、供應短缺藥品的供應,。其次,,近年來仿制藥一致性評價的開展,正改變著我國仿制藥行業(yè)長期以來“小,、亂,、散”的局面,集采常態(tài)化之下,,未來低壁壘仿制藥份額會緩慢下降,,高壁壘仿制藥份額將逐漸提升。目前,,兩批次鼓勵仿制藥品目錄中仍有15個產(chǎn)品暫無國內藥企涉足,,其中不乏羅氏、GSK,、艾伯維、諾和諾德等跨國藥企的最新產(chǎn)品,哪些國內藥企在未來會主動出擊,?我們將繼續(xù)跟蹤觀察,。 來源:中國政府網(wǎng)、米內網(wǎng)數(shù)據(jù)庫 審評數(shù)據(jù)統(tǒng)計截至3月19日,,如有錯漏,,敬請指正。



