醫(yī)藥網(wǎng)4月30日訊 4月29日,,國(guó)家藥典委員會(huì)官網(wǎng)發(fā)布了《關(guān)于執(zhí)行中藥配方顆粒國(guó)家藥品標(biāo)準(zhǔn)有關(guān)事項(xiàng)的通知》。 國(guó)家藥監(jiān)局近日正式批準(zhǔn)頒布了“第一批中藥配方顆粒國(guó)家標(biāo)準(zhǔn)(160個(gè))”。采訪中,,記者了解到,,第一批中藥配方顆粒國(guó)家標(biāo)準(zhǔn)頒布后,,設(shè)置6個(gè)月的過渡期,,將于2021年11月1日起正式實(shí)施。按照《關(guān)于結(jié)束中藥配方顆粒試點(diǎn)工作的公告》規(guī)定,,自實(shí)施之日起,,省級(jí)藥品監(jiān)督管理部門制定的相應(yīng)標(biāo)準(zhǔn)即行廢止。 此外,,還有39個(gè)中藥配方顆粒國(guó)家藥品標(biāo)準(zhǔn)正在審評(píng)過程中,,另有246個(gè)中藥配方顆粒品種已有企業(yè)正在開展標(biāo)準(zhǔn)研究。 需要提示的是:在標(biāo)準(zhǔn)執(zhí)行過程中,,生產(chǎn)企業(yè)需要進(jìn)一步積累數(shù)據(jù)并報(bào)送國(guó)家藥典委員會(huì),,以逐步完善和提高標(biāo)準(zhǔn)。后續(xù),,國(guó)家藥監(jiān)局將加快推進(jìn)中藥配方顆粒標(biāo)準(zhǔn)制定工作,,保障配方顆粒結(jié)束試點(diǎn)工作順利實(shí)施。 業(yè)內(nèi)專家認(rèn)為:“中藥配方顆粒國(guó)家標(biāo)準(zhǔn)的出臺(tái)有助于全面實(shí)現(xiàn)對(duì)中藥配方顆粒安全性,、有效性的整體質(zhì)量控制,,是一個(gè)具有歷史意義的工作,也是中醫(yī)藥產(chǎn)業(yè)的傳承和創(chuàng)新發(fā)展的一個(gè)重大里程碑,。” 試點(diǎn)企業(yè)超60家 2001年4月,《中藥配方顆粒管理暫行規(guī)定》頒布,,將中藥配方顆粒納入中藥飲片管理范疇,,實(shí)行批準(zhǔn)文號(hào)管理。6家企業(yè)獲得國(guó)家試點(diǎn)資質(zhì),占據(jù)了80%以上的市場(chǎng)份額,,分別為:江陰天江藥業(yè),、華潤(rùn)三九現(xiàn)代中藥、廣東一方制藥有限公司,、四川新綠色藥業(yè),、北京康仁堂藥業(yè)、南寧培力制藥,。 6家國(guó)家級(jí)試點(diǎn)企業(yè)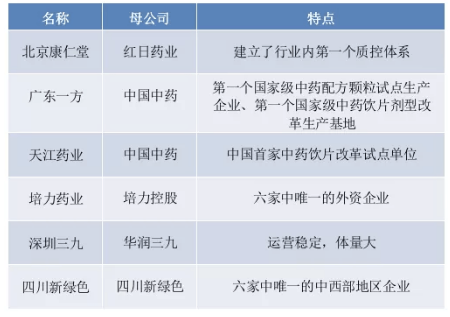 2015年,,《中藥配方顆粒管理辦法(征求意見稿)》(以下簡(jiǎn)稱《征求意見稿》)發(fā)布后,河北,、浙江,、黑龍江、吉林,、安徽,、陜西、河南,、山東,、江西、廣東等多個(gè)省份先后出臺(tái)文件,,以科研專項(xiàng),、試點(diǎn)研究、臨床試點(diǎn),、技改專項(xiàng)等多種名義批準(zhǔn)中藥配方顆粒試點(diǎn)企業(yè),,在省內(nèi)開展中藥配方顆粒科研生產(chǎn)試點(diǎn)及醫(yī)療機(jī)構(gòu)臨床使用,。 自去年2月以來,,已經(jīng)相繼有多家上市公司布局中藥配方顆粒生產(chǎn)基地。據(jù)新華社不完全統(tǒng)計(jì),,包括國(guó)家藥監(jiān)局最初批準(zhǔn)的6家中藥配方顆粒試點(diǎn)生產(chǎn)企業(yè),,以及2家省級(jí)試點(diǎn)企業(yè)在內(nèi),目前全國(guó)范圍內(nèi)共有超60家藥企獲得中藥配方顆粒的生產(chǎn)資格,。 2020年2月26日,,貴州批準(zhǔn)了1家(貴州益佰制藥股份有限公司),2019年3月,,貴州省藥監(jiān)局曾確認(rèn)國(guó)藥集團(tuán)同濟(jì)堂(貴州)制藥有限公司,、貴陽(yáng)新天藥業(yè)股份有限公司2家試點(diǎn)企業(yè);2019-2020年內(nèi)蒙古,、山東共批準(zhǔn)了8家(包括青州堯王制藥有限公司,、山東宏濟(jì)堂制藥集團(tuán)股份有限公司,、山東一方制藥有限公司、內(nèi)蒙古普康藥業(yè)有限公司,、祈蒙股份有限公司,、內(nèi)蒙古蒙藥股份有限公司、內(nèi)蒙古京新藥業(yè)有限公司,、包頭中藥有限責(zé)任公司),。 有消息人士透露,《征求意見稿》發(fā)布之初,,先期批準(zhǔn)省級(jí)試點(diǎn)的浙江,、江西等省份還默守批準(zhǔn)不多于3家的不成文之規(guī),而后來的省份批準(zhǔn)試點(diǎn)的數(shù)量迅速增多,,少則5家(如云南,、內(nèi)蒙),多則6家(河南,、湖北,、安徽)。 國(guó)標(biāo)強(qiáng)調(diào)一致性 業(yè)內(nèi)專家認(rèn)為,,一方面中藥配方顆粒相比一般的藥品擁有更大的銷售空間,,既不需要參與國(guó)家集中帶量采購(gòu),有的還可參照中藥飲片納入醫(yī)保報(bào)銷范疇,。另一方面,,疊加中藥配方顆粒相較于中藥飲片更方便攜帶且藥效等價(jià)的特性,隨著患者教育的深入,,其市場(chǎng)規(guī)模將得到持續(xù)擴(kuò)張,。 前瞻產(chǎn)業(yè)研究院數(shù)據(jù)顯示,2006-2016年中藥配方顆粒市場(chǎng)規(guī)模由2億元增長(zhǎng)到107億元,,年復(fù)合增長(zhǎng)率高達(dá)48.9%,,預(yù)計(jì)2020年中藥配方顆粒市場(chǎng)規(guī)模達(dá)到255億元。有機(jī)構(gòu)預(yù)測(cè)中藥配方顆粒行業(yè)在未來5年仍將保持快速增長(zhǎng),,預(yù)計(jì)到2023年,,行業(yè)規(guī)模將達(dá)492.1億元。 相關(guān)負(fù)責(zé)人介紹,,中藥配方顆粒國(guó)家標(biāo)準(zhǔn)體現(xiàn)了中藥質(zhì)量的控制特點(diǎn)和質(zhì)量全程管控理念,,以“標(biāo)準(zhǔn)湯劑”為基準(zhǔn)衡量配方顆粒與飲片湯劑的“一致性”,建立量值傳遞數(shù)據(jù)表與特征圖譜控制指標(biāo),,實(shí)現(xiàn)配方顆粒質(zhì)量專屬性與整體性的綜合管控,,提高中藥質(zhì)量整體控制水平。 在中藥配方顆粒國(guó)家標(biāo)準(zhǔn)研究制定過程中,,注重對(duì)多基原藥材品種的深入研究,,分析不同基原內(nèi)在質(zhì)量的差異,。標(biāo)準(zhǔn)原則上區(qū)分了不同基原,并建立了專屬的質(zhì)量標(biāo)準(zhǔn),。 另外,中藥配方顆粒國(guó)家標(biāo)準(zhǔn)基本均設(shè)置了薄層鑒別,、特征/指紋圖譜,、浸出物、含量測(cè)定等項(xiàng)目,。既可以很好地反映中藥配方顆粒的真?zhèn)?,又可體現(xiàn)其優(yōu)劣,同時(shí)充分反映了中藥復(fù)雜體系質(zhì)量控制的特點(diǎn),,更好地保證了中藥配方顆粒產(chǎn)品的質(zhì)量,。 隨著統(tǒng)一標(biāo)準(zhǔn)出臺(tái),市場(chǎng)混亂,、研發(fā)重復(fù)浪費(fèi)等制約行業(yè)發(fā)展的問題將解決,。未來的競(jìng)爭(zhēng)需要的是合規(guī)參與、技術(shù)競(jìng)爭(zhēng),、實(shí)力背書,。此外,隨著試點(diǎn)政策的結(jié)束,,未來中藥配方顆粒市場(chǎng)競(jìng)爭(zhēng)將更加激烈,,現(xiàn)有格局有望被打破。 目前,,中藥配方顆粒行業(yè)還處于起步階段,,藥企要做的第一件事是緊跟政策走向,不斷提高以質(zhì)量為核心的競(jìng)爭(zhēng)力,,才能在這個(gè)百億大市場(chǎng)中瓜分更多的份額,。
2015年,,《中藥配方顆粒管理辦法(征求意見稿)》(以下簡(jiǎn)稱《征求意見稿》)發(fā)布后,河北,、浙江,、黑龍江、吉林,、安徽,、陜西、河南,、山東,、江西、廣東等多個(gè)省份先后出臺(tái)文件,,以科研專項(xiàng),、試點(diǎn)研究、臨床試點(diǎn),、技改專項(xiàng)等多種名義批準(zhǔn)中藥配方顆粒試點(diǎn)企業(yè),,在省內(nèi)開展中藥配方顆粒科研生產(chǎn)試點(diǎn)及醫(yī)療機(jī)構(gòu)臨床使用,。 自去年2月以來,,已經(jīng)相繼有多家上市公司布局中藥配方顆粒生產(chǎn)基地。據(jù)新華社不完全統(tǒng)計(jì),,包括國(guó)家藥監(jiān)局最初批準(zhǔn)的6家中藥配方顆粒試點(diǎn)生產(chǎn)企業(yè),,以及2家省級(jí)試點(diǎn)企業(yè)在內(nèi),目前全國(guó)范圍內(nèi)共有超60家藥企獲得中藥配方顆粒的生產(chǎn)資格,。 2020年2月26日,,貴州批準(zhǔn)了1家(貴州益佰制藥股份有限公司),2019年3月,,貴州省藥監(jiān)局曾確認(rèn)國(guó)藥集團(tuán)同濟(jì)堂(貴州)制藥有限公司,、貴陽(yáng)新天藥業(yè)股份有限公司2家試點(diǎn)企業(yè);2019-2020年內(nèi)蒙古,、山東共批準(zhǔn)了8家(包括青州堯王制藥有限公司,、山東宏濟(jì)堂制藥集團(tuán)股份有限公司,、山東一方制藥有限公司、內(nèi)蒙古普康藥業(yè)有限公司,、祈蒙股份有限公司,、內(nèi)蒙古蒙藥股份有限公司、內(nèi)蒙古京新藥業(yè)有限公司,、包頭中藥有限責(zé)任公司),。 有消息人士透露,《征求意見稿》發(fā)布之初,,先期批準(zhǔn)省級(jí)試點(diǎn)的浙江,、江西等省份還默守批準(zhǔn)不多于3家的不成文之規(guī),而后來的省份批準(zhǔn)試點(diǎn)的數(shù)量迅速增多,,少則5家(如云南,、內(nèi)蒙),多則6家(河南,、湖北,、安徽)。 國(guó)標(biāo)強(qiáng)調(diào)一致性 業(yè)內(nèi)專家認(rèn)為,,一方面中藥配方顆粒相比一般的藥品擁有更大的銷售空間,,既不需要參與國(guó)家集中帶量采購(gòu),有的還可參照中藥飲片納入醫(yī)保報(bào)銷范疇,。另一方面,,疊加中藥配方顆粒相較于中藥飲片更方便攜帶且藥效等價(jià)的特性,隨著患者教育的深入,,其市場(chǎng)規(guī)模將得到持續(xù)擴(kuò)張,。 前瞻產(chǎn)業(yè)研究院數(shù)據(jù)顯示,2006-2016年中藥配方顆粒市場(chǎng)規(guī)模由2億元增長(zhǎng)到107億元,,年復(fù)合增長(zhǎng)率高達(dá)48.9%,,預(yù)計(jì)2020年中藥配方顆粒市場(chǎng)規(guī)模達(dá)到255億元。有機(jī)構(gòu)預(yù)測(cè)中藥配方顆粒行業(yè)在未來5年仍將保持快速增長(zhǎng),,預(yù)計(jì)到2023年,,行業(yè)規(guī)模將達(dá)492.1億元。 相關(guān)負(fù)責(zé)人介紹,,中藥配方顆粒國(guó)家標(biāo)準(zhǔn)體現(xiàn)了中藥質(zhì)量的控制特點(diǎn)和質(zhì)量全程管控理念,,以“標(biāo)準(zhǔn)湯劑”為基準(zhǔn)衡量配方顆粒與飲片湯劑的“一致性”,建立量值傳遞數(shù)據(jù)表與特征圖譜控制指標(biāo),,實(shí)現(xiàn)配方顆粒質(zhì)量專屬性與整體性的綜合管控,,提高中藥質(zhì)量整體控制水平。 在中藥配方顆粒國(guó)家標(biāo)準(zhǔn)研究制定過程中,,注重對(duì)多基原藥材品種的深入研究,,分析不同基原內(nèi)在質(zhì)量的差異,。標(biāo)準(zhǔn)原則上區(qū)分了不同基原,并建立了專屬的質(zhì)量標(biāo)準(zhǔn),。 另外,中藥配方顆粒國(guó)家標(biāo)準(zhǔn)基本均設(shè)置了薄層鑒別,、特征/指紋圖譜,、浸出物、含量測(cè)定等項(xiàng)目,。既可以很好地反映中藥配方顆粒的真?zhèn)?,又可體現(xiàn)其優(yōu)劣,同時(shí)充分反映了中藥復(fù)雜體系質(zhì)量控制的特點(diǎn),,更好地保證了中藥配方顆粒產(chǎn)品的質(zhì)量,。 隨著統(tǒng)一標(biāo)準(zhǔn)出臺(tái),市場(chǎng)混亂,、研發(fā)重復(fù)浪費(fèi)等制約行業(yè)發(fā)展的問題將解決,。未來的競(jìng)爭(zhēng)需要的是合規(guī)參與、技術(shù)競(jìng)爭(zhēng),、實(shí)力背書,。此外,隨著試點(diǎn)政策的結(jié)束,,未來中藥配方顆粒市場(chǎng)競(jìng)爭(zhēng)將更加激烈,,現(xiàn)有格局有望被打破。 目前,,中藥配方顆粒行業(yè)還處于起步階段,,藥企要做的第一件事是緊跟政策走向,不斷提高以質(zhì)量為核心的競(jìng)爭(zhēng)力,,才能在這個(gè)百億大市場(chǎng)中瓜分更多的份額,。
 2015年,,《中藥配方顆粒管理辦法(征求意見稿)》(以下簡(jiǎn)稱《征求意見稿》)發(fā)布后,河北,、浙江,、黑龍江、吉林,、安徽,、陜西、河南,、山東,、江西、廣東等多個(gè)省份先后出臺(tái)文件,,以科研專項(xiàng),、試點(diǎn)研究、臨床試點(diǎn),、技改專項(xiàng)等多種名義批準(zhǔn)中藥配方顆粒試點(diǎn)企業(yè),,在省內(nèi)開展中藥配方顆粒科研生產(chǎn)試點(diǎn)及醫(yī)療機(jī)構(gòu)臨床使用,。 自去年2月以來,,已經(jīng)相繼有多家上市公司布局中藥配方顆粒生產(chǎn)基地。據(jù)新華社不完全統(tǒng)計(jì),,包括國(guó)家藥監(jiān)局最初批準(zhǔn)的6家中藥配方顆粒試點(diǎn)生產(chǎn)企業(yè),,以及2家省級(jí)試點(diǎn)企業(yè)在內(nèi),目前全國(guó)范圍內(nèi)共有超60家藥企獲得中藥配方顆粒的生產(chǎn)資格,。 2020年2月26日,,貴州批準(zhǔn)了1家(貴州益佰制藥股份有限公司),2019年3月,,貴州省藥監(jiān)局曾確認(rèn)國(guó)藥集團(tuán)同濟(jì)堂(貴州)制藥有限公司,、貴陽(yáng)新天藥業(yè)股份有限公司2家試點(diǎn)企業(yè);2019-2020年內(nèi)蒙古,、山東共批準(zhǔn)了8家(包括青州堯王制藥有限公司,、山東宏濟(jì)堂制藥集團(tuán)股份有限公司,、山東一方制藥有限公司、內(nèi)蒙古普康藥業(yè)有限公司,、祈蒙股份有限公司,、內(nèi)蒙古蒙藥股份有限公司、內(nèi)蒙古京新藥業(yè)有限公司,、包頭中藥有限責(zé)任公司),。 有消息人士透露,《征求意見稿》發(fā)布之初,,先期批準(zhǔn)省級(jí)試點(diǎn)的浙江,、江西等省份還默守批準(zhǔn)不多于3家的不成文之規(guī),而后來的省份批準(zhǔn)試點(diǎn)的數(shù)量迅速增多,,少則5家(如云南,、內(nèi)蒙),多則6家(河南,、湖北,、安徽)。 國(guó)標(biāo)強(qiáng)調(diào)一致性 業(yè)內(nèi)專家認(rèn)為,,一方面中藥配方顆粒相比一般的藥品擁有更大的銷售空間,,既不需要參與國(guó)家集中帶量采購(gòu),有的還可參照中藥飲片納入醫(yī)保報(bào)銷范疇,。另一方面,,疊加中藥配方顆粒相較于中藥飲片更方便攜帶且藥效等價(jià)的特性,隨著患者教育的深入,,其市場(chǎng)規(guī)模將得到持續(xù)擴(kuò)張,。 前瞻產(chǎn)業(yè)研究院數(shù)據(jù)顯示,2006-2016年中藥配方顆粒市場(chǎng)規(guī)模由2億元增長(zhǎng)到107億元,,年復(fù)合增長(zhǎng)率高達(dá)48.9%,,預(yù)計(jì)2020年中藥配方顆粒市場(chǎng)規(guī)模達(dá)到255億元。有機(jī)構(gòu)預(yù)測(cè)中藥配方顆粒行業(yè)在未來5年仍將保持快速增長(zhǎng),,預(yù)計(jì)到2023年,,行業(yè)規(guī)模將達(dá)492.1億元。 相關(guān)負(fù)責(zé)人介紹,,中藥配方顆粒國(guó)家標(biāo)準(zhǔn)體現(xiàn)了中藥質(zhì)量的控制特點(diǎn)和質(zhì)量全程管控理念,,以“標(biāo)準(zhǔn)湯劑”為基準(zhǔn)衡量配方顆粒與飲片湯劑的“一致性”,建立量值傳遞數(shù)據(jù)表與特征圖譜控制指標(biāo),,實(shí)現(xiàn)配方顆粒質(zhì)量專屬性與整體性的綜合管控,,提高中藥質(zhì)量整體控制水平。 在中藥配方顆粒國(guó)家標(biāo)準(zhǔn)研究制定過程中,,注重對(duì)多基原藥材品種的深入研究,,分析不同基原內(nèi)在質(zhì)量的差異,。標(biāo)準(zhǔn)原則上區(qū)分了不同基原,并建立了專屬的質(zhì)量標(biāo)準(zhǔn),。 另外,中藥配方顆粒國(guó)家標(biāo)準(zhǔn)基本均設(shè)置了薄層鑒別,、特征/指紋圖譜,、浸出物、含量測(cè)定等項(xiàng)目,。既可以很好地反映中藥配方顆粒的真?zhèn)?,又可體現(xiàn)其優(yōu)劣,同時(shí)充分反映了中藥復(fù)雜體系質(zhì)量控制的特點(diǎn),,更好地保證了中藥配方顆粒產(chǎn)品的質(zhì)量,。 隨著統(tǒng)一標(biāo)準(zhǔn)出臺(tái),市場(chǎng)混亂,、研發(fā)重復(fù)浪費(fèi)等制約行業(yè)發(fā)展的問題將解決,。未來的競(jìng)爭(zhēng)需要的是合規(guī)參與、技術(shù)競(jìng)爭(zhēng),、實(shí)力背書,。此外,隨著試點(diǎn)政策的結(jié)束,,未來中藥配方顆粒市場(chǎng)競(jìng)爭(zhēng)將更加激烈,,現(xiàn)有格局有望被打破。 目前,,中藥配方顆粒行業(yè)還處于起步階段,,藥企要做的第一件事是緊跟政策走向,不斷提高以質(zhì)量為核心的競(jìng)爭(zhēng)力,,才能在這個(gè)百億大市場(chǎng)中瓜分更多的份額,。
2015年,,《中藥配方顆粒管理辦法(征求意見稿)》(以下簡(jiǎn)稱《征求意見稿》)發(fā)布后,河北,、浙江,、黑龍江、吉林,、安徽,、陜西、河南,、山東,、江西、廣東等多個(gè)省份先后出臺(tái)文件,,以科研專項(xiàng),、試點(diǎn)研究、臨床試點(diǎn),、技改專項(xiàng)等多種名義批準(zhǔn)中藥配方顆粒試點(diǎn)企業(yè),,在省內(nèi)開展中藥配方顆粒科研生產(chǎn)試點(diǎn)及醫(yī)療機(jī)構(gòu)臨床使用,。 自去年2月以來,,已經(jīng)相繼有多家上市公司布局中藥配方顆粒生產(chǎn)基地。據(jù)新華社不完全統(tǒng)計(jì),,包括國(guó)家藥監(jiān)局最初批準(zhǔn)的6家中藥配方顆粒試點(diǎn)生產(chǎn)企業(yè),,以及2家省級(jí)試點(diǎn)企業(yè)在內(nèi),目前全國(guó)范圍內(nèi)共有超60家藥企獲得中藥配方顆粒的生產(chǎn)資格,。 2020年2月26日,,貴州批準(zhǔn)了1家(貴州益佰制藥股份有限公司),2019年3月,,貴州省藥監(jiān)局曾確認(rèn)國(guó)藥集團(tuán)同濟(jì)堂(貴州)制藥有限公司,、貴陽(yáng)新天藥業(yè)股份有限公司2家試點(diǎn)企業(yè);2019-2020年內(nèi)蒙古,、山東共批準(zhǔn)了8家(包括青州堯王制藥有限公司,、山東宏濟(jì)堂制藥集團(tuán)股份有限公司,、山東一方制藥有限公司、內(nèi)蒙古普康藥業(yè)有限公司,、祈蒙股份有限公司,、內(nèi)蒙古蒙藥股份有限公司、內(nèi)蒙古京新藥業(yè)有限公司,、包頭中藥有限責(zé)任公司),。 有消息人士透露,《征求意見稿》發(fā)布之初,,先期批準(zhǔn)省級(jí)試點(diǎn)的浙江,、江西等省份還默守批準(zhǔn)不多于3家的不成文之規(guī),而后來的省份批準(zhǔn)試點(diǎn)的數(shù)量迅速增多,,少則5家(如云南,、內(nèi)蒙),多則6家(河南,、湖北,、安徽)。 國(guó)標(biāo)強(qiáng)調(diào)一致性 業(yè)內(nèi)專家認(rèn)為,,一方面中藥配方顆粒相比一般的藥品擁有更大的銷售空間,,既不需要參與國(guó)家集中帶量采購(gòu),有的還可參照中藥飲片納入醫(yī)保報(bào)銷范疇,。另一方面,,疊加中藥配方顆粒相較于中藥飲片更方便攜帶且藥效等價(jià)的特性,隨著患者教育的深入,,其市場(chǎng)規(guī)模將得到持續(xù)擴(kuò)張,。 前瞻產(chǎn)業(yè)研究院數(shù)據(jù)顯示,2006-2016年中藥配方顆粒市場(chǎng)規(guī)模由2億元增長(zhǎng)到107億元,,年復(fù)合增長(zhǎng)率高達(dá)48.9%,,預(yù)計(jì)2020年中藥配方顆粒市場(chǎng)規(guī)模達(dá)到255億元。有機(jī)構(gòu)預(yù)測(cè)中藥配方顆粒行業(yè)在未來5年仍將保持快速增長(zhǎng),,預(yù)計(jì)到2023年,,行業(yè)規(guī)模將達(dá)492.1億元。 相關(guān)負(fù)責(zé)人介紹,,中藥配方顆粒國(guó)家標(biāo)準(zhǔn)體現(xiàn)了中藥質(zhì)量的控制特點(diǎn)和質(zhì)量全程管控理念,,以“標(biāo)準(zhǔn)湯劑”為基準(zhǔn)衡量配方顆粒與飲片湯劑的“一致性”,建立量值傳遞數(shù)據(jù)表與特征圖譜控制指標(biāo),,實(shí)現(xiàn)配方顆粒質(zhì)量專屬性與整體性的綜合管控,,提高中藥質(zhì)量整體控制水平。 在中藥配方顆粒國(guó)家標(biāo)準(zhǔn)研究制定過程中,,注重對(duì)多基原藥材品種的深入研究,,分析不同基原內(nèi)在質(zhì)量的差異,。標(biāo)準(zhǔn)原則上區(qū)分了不同基原,并建立了專屬的質(zhì)量標(biāo)準(zhǔn),。 另外,中藥配方顆粒國(guó)家標(biāo)準(zhǔn)基本均設(shè)置了薄層鑒別,、特征/指紋圖譜,、浸出物、含量測(cè)定等項(xiàng)目,。既可以很好地反映中藥配方顆粒的真?zhèn)?,又可體現(xiàn)其優(yōu)劣,同時(shí)充分反映了中藥復(fù)雜體系質(zhì)量控制的特點(diǎn),,更好地保證了中藥配方顆粒產(chǎn)品的質(zhì)量,。 隨著統(tǒng)一標(biāo)準(zhǔn)出臺(tái),市場(chǎng)混亂,、研發(fā)重復(fù)浪費(fèi)等制約行業(yè)發(fā)展的問題將解決,。未來的競(jìng)爭(zhēng)需要的是合規(guī)參與、技術(shù)競(jìng)爭(zhēng),、實(shí)力背書,。此外,隨著試點(diǎn)政策的結(jié)束,,未來中藥配方顆粒市場(chǎng)競(jìng)爭(zhēng)將更加激烈,,現(xiàn)有格局有望被打破。 目前,,中藥配方顆粒行業(yè)還處于起步階段,,藥企要做的第一件事是緊跟政策走向,不斷提高以質(zhì)量為核心的競(jìng)爭(zhēng)力,,才能在這個(gè)百億大市場(chǎng)中瓜分更多的份額,。