醫(yī)藥網(wǎng)1月17日訊 2018年,是醫(yī)療器械GMP全面鋪開的元年,,也是醫(yī)療監(jiān)管加強(qiáng)加嚴(yán)的關(guān)鍵之年,,尤其以長春長生生物的疫苗案為標(biāo)志性事件,,醫(yī)療制造行業(yè)的合規(guī)掀起了一場自頂層而下的風(fēng)暴,。在2019的新年伊始,聯(lián)盟就帶您回顧一下2018年國家局的飛檢情況,,用一串串數(shù)據(jù)來辨清監(jiān)管形勢,,透析法規(guī)要點(diǎn)。
1,、2018年到底有多少家器械生產(chǎn)企業(yè)被國家局飛檢,?
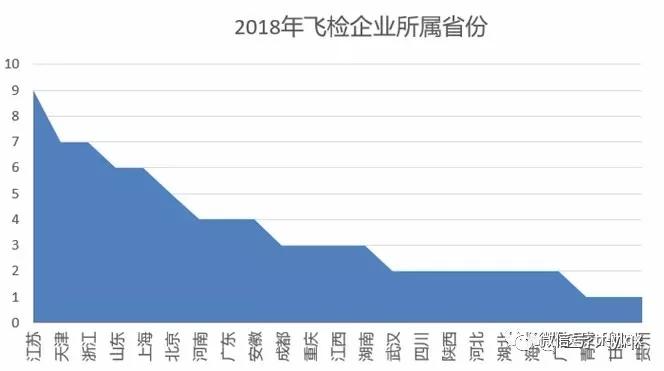
縱觀NMPA新網(wǎng)站的飛行檢查一欄,飛檢部隊(duì)還是蠻拼的,,2018年足跡遍布23個省,,共88家器械生產(chǎn)企業(yè)受到檢查。通過下圖可以看出,,NMPA偏愛江,、浙、滬和北京,、天津,、山東,因?yàn)檫@些都是器械大省啊,。
 如果細(xì)究起來,,88家企業(yè)當(dāng)中,有20家企業(yè)正處于停產(chǎn)狀態(tài),。也可以理解為,,飛檢就是要看看這些停產(chǎn)企業(yè)是否真的停產(chǎn),還是故弄玄虛,。值得一提的是,,雖然陜西仁康藥業(yè)有限公司處于停產(chǎn)狀態(tài),但是也被從查出了6條一般缺陷,,看來停產(chǎn)企業(yè)只要記錄還在,,仍處于飛檢監(jiān)控之下。本文就主要圍繞著有檢查缺陷的69家企業(yè)說開來去,。
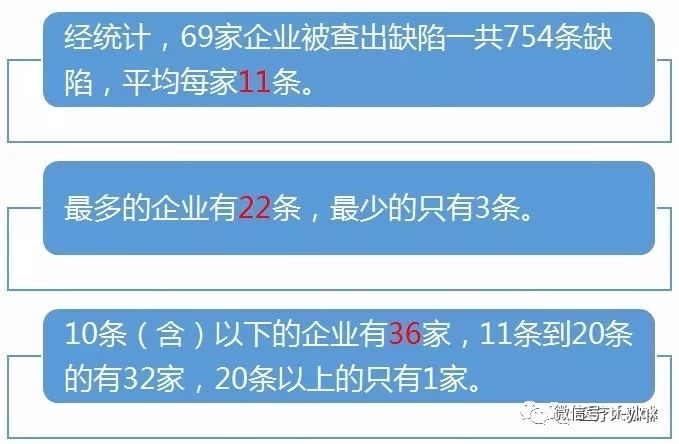
2,、一般企業(yè)被查都有多少缺陷?
如果細(xì)究起來,,88家企業(yè)當(dāng)中,有20家企業(yè)正處于停產(chǎn)狀態(tài),。也可以理解為,,飛檢就是要看看這些停產(chǎn)企業(yè)是否真的停產(chǎn),還是故弄玄虛,。值得一提的是,,雖然陜西仁康藥業(yè)有限公司處于停產(chǎn)狀態(tài),但是也被從查出了6條一般缺陷,,看來停產(chǎn)企業(yè)只要記錄還在,,仍處于飛檢監(jiān)控之下。本文就主要圍繞著有檢查缺陷的69家企業(yè)說開來去,。
2,、一般企業(yè)被查都有多少缺陷?
 3,、有多少家停產(chǎn)整頓,,又有多少限期整改,?
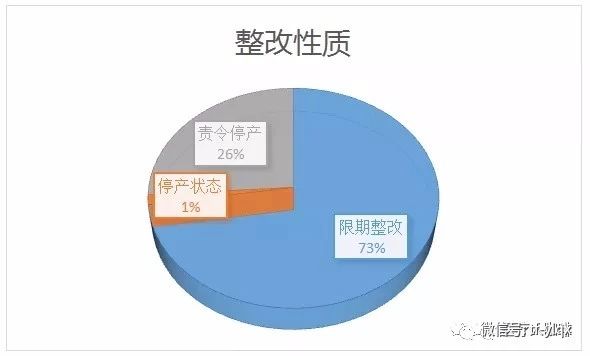
69家企業(yè),1家處于停產(chǎn)狀態(tài),,18家責(zé)令停產(chǎn)整改,,50家限期整改。
3,、有多少家停產(chǎn)整頓,,又有多少限期整改,?
69家企業(yè),1家處于停產(chǎn)狀態(tài),,18家責(zé)令停產(chǎn)整改,,50家限期整改。
 4,、GMP條款,,企業(yè)最容易犯什么錯?
2018年的飛檢缺陷共754條,,分別落在《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》,、& 無菌附錄& 、& 植入附錄& ,、& 體外診斷試劑附錄& 和& 義齒附錄& 的156個條款上,。
4,、GMP條款,,企業(yè)最容易犯什么錯?
2018年的飛檢缺陷共754條,,分別落在《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》,、& 無菌附錄& 、& 植入附錄& ,、& 體外診斷試劑附錄& 和& 義齒附錄& 的156個條款上,。
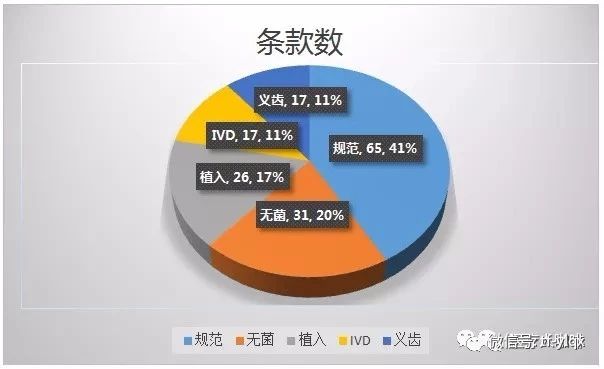 缺陷對應(yīng)條款,預(yù)料之中主要是與規(guī)范相關(guān)的條款,,涉及542條,,其次是無菌105條。
缺陷對應(yīng)條款,預(yù)料之中主要是與規(guī)范相關(guān)的條款,,涉及542條,,其次是無菌105條。
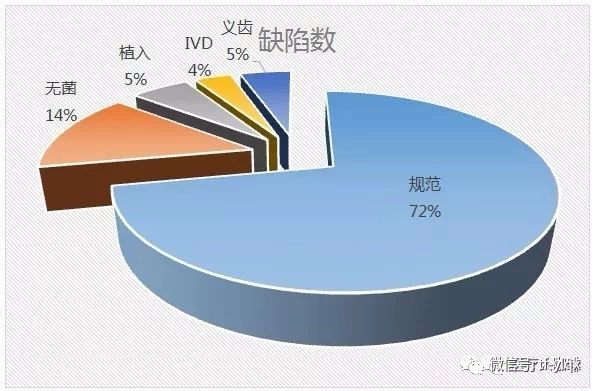 考慮缺陷的集中度,,對重復(fù)10次出現(xiàn)的條款號進(jìn)行梳理,,發(fā)現(xiàn)有20個條款最容易出現(xiàn)問題,總共出現(xiàn)缺陷404項(xiàng),,占總數(shù)的53.6%,。
考慮缺陷的集中度,,對重復(fù)10次出現(xiàn)的條款號進(jìn)行梳理,,發(fā)現(xiàn)有20個條款最容易出現(xiàn)問題,總共出現(xiàn)缺陷404項(xiàng),,占總數(shù)的53.6%,。
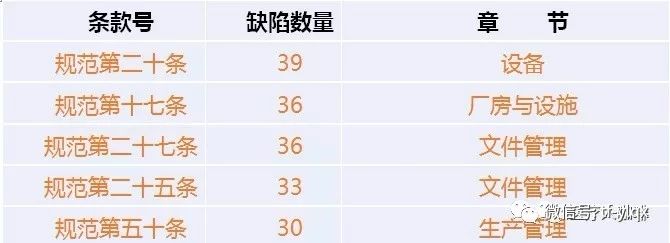
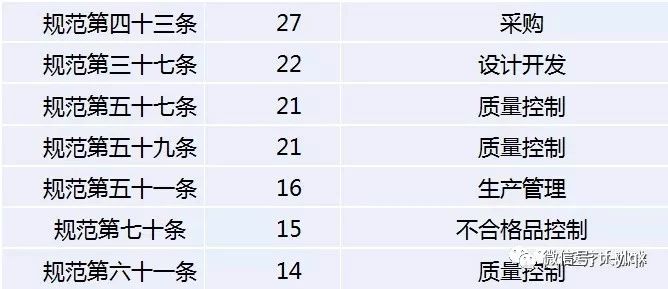
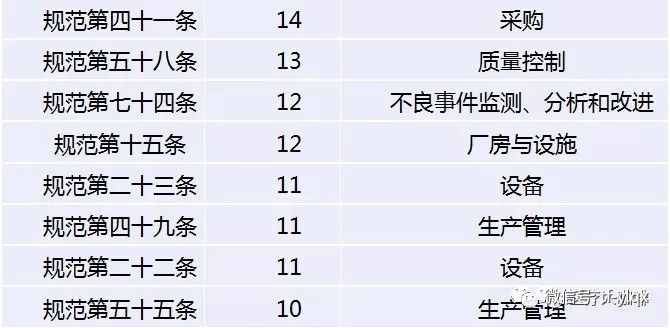
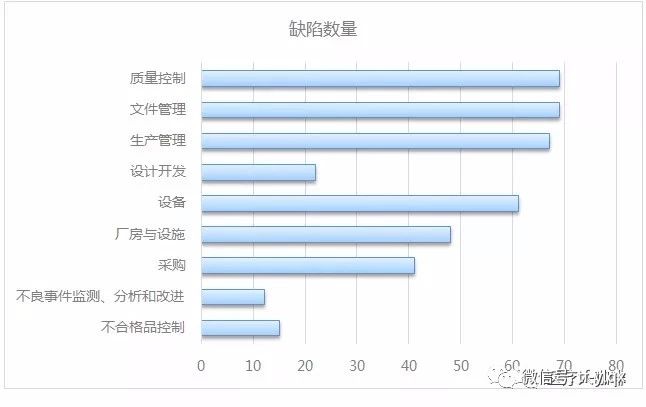 其中,質(zhì)量控制,、文件管理,、生產(chǎn)管理和設(shè)備設(shè)施是重災(zāi)區(qū)。
5,、停產(chǎn)整頓的企業(yè)要害問題是什么,?
其中,質(zhì)量控制,、文件管理,、生產(chǎn)管理和設(shè)備設(shè)施是重災(zāi)區(qū)。
5,、停產(chǎn)整頓的企業(yè)要害問題是什么,?
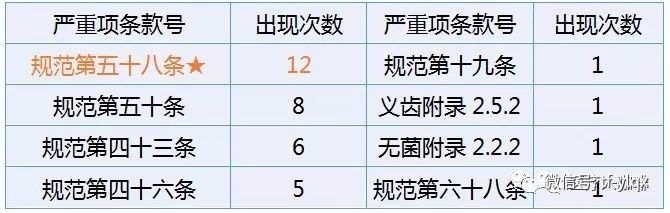 上表可以看出,規(guī)范第五十八條實(shí)為飛檢的殺手锏,。
& 第五十八條 企業(yè)應(yīng)當(dāng)根據(jù)強(qiáng)制性標(biāo)準(zhǔn)以及經(jīng)注冊或者備案的產(chǎn)品技術(shù)要求制定產(chǎn)品的檢驗(yàn)規(guī)程,,并出具相應(yīng)的檢驗(yàn)報(bào)告或者證書。
需要常規(guī)控制的進(jìn)貨檢驗(yàn),、過程檢驗(yàn)和成品檢驗(yàn)項(xiàng)目原則上不得進(jìn)行委托檢驗(yàn),。對于檢驗(yàn)條件和設(shè)備要求較高,確需委托檢驗(yàn)的項(xiàng)目,,可委托具有資質(zhì)的機(jī)構(gòu)進(jìn)行檢驗(yàn),,以證明產(chǎn)品符合強(qiáng)制性標(biāo)準(zhǔn)和經(jīng)注冊或者備案的產(chǎn)品技術(shù)要求。&
到底這12項(xiàng)嚴(yán)重缺陷是哪些呢,,詳見下表,。
上表可以看出,規(guī)范第五十八條實(shí)為飛檢的殺手锏,。
& 第五十八條 企業(yè)應(yīng)當(dāng)根據(jù)強(qiáng)制性標(biāo)準(zhǔn)以及經(jīng)注冊或者備案的產(chǎn)品技術(shù)要求制定產(chǎn)品的檢驗(yàn)規(guī)程,,并出具相應(yīng)的檢驗(yàn)報(bào)告或者證書。
需要常規(guī)控制的進(jìn)貨檢驗(yàn),、過程檢驗(yàn)和成品檢驗(yàn)項(xiàng)目原則上不得進(jìn)行委托檢驗(yàn),。對于檢驗(yàn)條件和設(shè)備要求較高,確需委托檢驗(yàn)的項(xiàng)目,,可委托具有資質(zhì)的機(jī)構(gòu)進(jìn)行檢驗(yàn),,以證明產(chǎn)品符合強(qiáng)制性標(biāo)準(zhǔn)和經(jīng)注冊或者備案的產(chǎn)品技術(shù)要求。&
到底這12項(xiàng)嚴(yán)重缺陷是哪些呢,,詳見下表,。
從上嚴(yán)重項(xiàng)可以看出,,檢驗(yàn)項(xiàng)目的缺失,、檢驗(yàn)方法與文件規(guī)定不一致、檢驗(yàn)設(shè)備配置不到位,、檢驗(yàn)記錄不完整是最容易一招斃命的,。
 如果細(xì)究起來,,88家企業(yè)當(dāng)中,有20家企業(yè)正處于停產(chǎn)狀態(tài),。也可以理解為,,飛檢就是要看看這些停產(chǎn)企業(yè)是否真的停產(chǎn),還是故弄玄虛,。值得一提的是,,雖然陜西仁康藥業(yè)有限公司處于停產(chǎn)狀態(tài),但是也被從查出了6條一般缺陷,,看來停產(chǎn)企業(yè)只要記錄還在,,仍處于飛檢監(jiān)控之下。本文就主要圍繞著有檢查缺陷的69家企業(yè)說開來去,。
2,、一般企業(yè)被查都有多少缺陷?
如果細(xì)究起來,,88家企業(yè)當(dāng)中,有20家企業(yè)正處于停產(chǎn)狀態(tài),。也可以理解為,,飛檢就是要看看這些停產(chǎn)企業(yè)是否真的停產(chǎn),還是故弄玄虛,。值得一提的是,,雖然陜西仁康藥業(yè)有限公司處于停產(chǎn)狀態(tài),但是也被從查出了6條一般缺陷,,看來停產(chǎn)企業(yè)只要記錄還在,,仍處于飛檢監(jiān)控之下。本文就主要圍繞著有檢查缺陷的69家企業(yè)說開來去,。
2,、一般企業(yè)被查都有多少缺陷?
 3,、有多少家停產(chǎn)整頓,,又有多少限期整改,?
69家企業(yè),1家處于停產(chǎn)狀態(tài),,18家責(zé)令停產(chǎn)整改,,50家限期整改。
3,、有多少家停產(chǎn)整頓,,又有多少限期整改,?
69家企業(yè),1家處于停產(chǎn)狀態(tài),,18家責(zé)令停產(chǎn)整改,,50家限期整改。
 4,、GMP條款,,企業(yè)最容易犯什么錯?
2018年的飛檢缺陷共754條,,分別落在《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》,、& 無菌附錄& 、& 植入附錄& ,、& 體外診斷試劑附錄& 和& 義齒附錄& 的156個條款上,。
4,、GMP條款,,企業(yè)最容易犯什么錯?
2018年的飛檢缺陷共754條,,分別落在《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》,、& 無菌附錄& 、& 植入附錄& ,、& 體外診斷試劑附錄& 和& 義齒附錄& 的156個條款上,。
 缺陷對應(yīng)條款,預(yù)料之中主要是與規(guī)范相關(guān)的條款,,涉及542條,,其次是無菌105條。
缺陷對應(yīng)條款,預(yù)料之中主要是與規(guī)范相關(guān)的條款,,涉及542條,,其次是無菌105條。
 考慮缺陷的集中度,,對重復(fù)10次出現(xiàn)的條款號進(jìn)行梳理,,發(fā)現(xiàn)有20個條款最容易出現(xiàn)問題,總共出現(xiàn)缺陷404項(xiàng),,占總數(shù)的53.6%,。
考慮缺陷的集中度,,對重復(fù)10次出現(xiàn)的條款號進(jìn)行梳理,,發(fā)現(xiàn)有20個條款最容易出現(xiàn)問題,總共出現(xiàn)缺陷404項(xiàng),,占總數(shù)的53.6%,。



 其中,質(zhì)量控制,、文件管理,、生產(chǎn)管理和設(shè)備設(shè)施是重災(zāi)區(qū)。
5,、停產(chǎn)整頓的企業(yè)要害問題是什么,?
其中,質(zhì)量控制,、文件管理,、生產(chǎn)管理和設(shè)備設(shè)施是重災(zāi)區(qū)。
5,、停產(chǎn)整頓的企業(yè)要害問題是什么,?
 上表可以看出,規(guī)范第五十八條實(shí)為飛檢的殺手锏,。
& 第五十八條 企業(yè)應(yīng)當(dāng)根據(jù)強(qiáng)制性標(biāo)準(zhǔn)以及經(jīng)注冊或者備案的產(chǎn)品技術(shù)要求制定產(chǎn)品的檢驗(yàn)規(guī)程,,并出具相應(yīng)的檢驗(yàn)報(bào)告或者證書。
需要常規(guī)控制的進(jìn)貨檢驗(yàn),、過程檢驗(yàn)和成品檢驗(yàn)項(xiàng)目原則上不得進(jìn)行委托檢驗(yàn),。對于檢驗(yàn)條件和設(shè)備要求較高,確需委托檢驗(yàn)的項(xiàng)目,,可委托具有資質(zhì)的機(jī)構(gòu)進(jìn)行檢驗(yàn),,以證明產(chǎn)品符合強(qiáng)制性標(biāo)準(zhǔn)和經(jīng)注冊或者備案的產(chǎn)品技術(shù)要求。&
到底這12項(xiàng)嚴(yán)重缺陷是哪些呢,,詳見下表,。
上表可以看出,規(guī)范第五十八條實(shí)為飛檢的殺手锏,。
& 第五十八條 企業(yè)應(yīng)當(dāng)根據(jù)強(qiáng)制性標(biāo)準(zhǔn)以及經(jīng)注冊或者備案的產(chǎn)品技術(shù)要求制定產(chǎn)品的檢驗(yàn)規(guī)程,,并出具相應(yīng)的檢驗(yàn)報(bào)告或者證書。
需要常規(guī)控制的進(jìn)貨檢驗(yàn),、過程檢驗(yàn)和成品檢驗(yàn)項(xiàng)目原則上不得進(jìn)行委托檢驗(yàn),。對于檢驗(yàn)條件和設(shè)備要求較高,確需委托檢驗(yàn)的項(xiàng)目,,可委托具有資質(zhì)的機(jī)構(gòu)進(jìn)行檢驗(yàn),,以證明產(chǎn)品符合強(qiáng)制性標(biāo)準(zhǔn)和經(jīng)注冊或者備案的產(chǎn)品技術(shù)要求。&
到底這12項(xiàng)嚴(yán)重缺陷是哪些呢,,詳見下表,。
| 序號 | 內(nèi)容 |
| 1 | 產(chǎn)品檢驗(yàn)規(guī)程未涵蓋經(jīng)注冊的產(chǎn)品技術(shù)要求中的如下性能指標(biāo):彎曲性能,、彎曲彈性模量、X射線阻射性能,、拉伸粘接強(qiáng)度,、剪切粘接強(qiáng)度、組成成分及百分含量,。 |
| 2 | 未能嚴(yán)格按照國家強(qiáng)制性標(biāo)準(zhǔn)制定出廠檢驗(yàn)規(guī)程及檢驗(yàn),。1)高頻漏電流測試,GB9706.4要求負(fù)載電阻200歐姆,,測試電阻200歐姆,,線間距50cm,。檢測人員操作用負(fù)載電阻400歐姆,,測試電阻200歐姆,線間距25cm進(jìn)行測試,。2)生產(chǎn)過程中抽查電纜耐壓試驗(yàn),,操作規(guī)程要求10s升到1000V,保持1min,;實(shí)際是20s升到1000V,,保持40s。在成品檢驗(yàn)中,,高頻漏電流測試要求10s升到1000V,,保持1min;實(shí)際在18s上升到4000V,,保持42s,。 |
| 3 |
企業(yè)制定的環(huán)氧乙烷殘留量檢驗(yàn)方法要求,檢測時應(yīng)分別配制1μg/ml-10μg/ml的6個濃度的標(biāo)準(zhǔn)曲線后進(jìn)行檢測,,但檢查發(fā)現(xiàn):1.滅菌日期為2018年8月3日某批號產(chǎn)品的環(huán)氧乙烷殘留量檢驗(yàn)企業(yè)僅配制5個濃度標(biāo)準(zhǔn)曲線,; 滅菌日期為2018年4月28日生產(chǎn)的某批號產(chǎn)品的環(huán)氧乙烷殘留量檢驗(yàn),企業(yè)配制的標(biāo)準(zhǔn)曲線所用溶液濃度為1μg/ml-40μg/ml,。 |
| 4 | 批號20170214的一次性使用無菌陰道擴(kuò)張器檢驗(yàn)報(bào)告書中& 無菌(生物菌片)試驗(yàn)原始記錄& 顯示,,采用菌片試驗(yàn)方法檢驗(yàn)無菌項(xiàng)目,與檢驗(yàn)依據(jù)YZB/贛2327-2013《一次性使用無菌陰道擴(kuò)張器》的無菌檢驗(yàn)方法不一致,。 |
| 5 | 醫(yī)用鈥(Ho:YAG)激光治療機(jī)成品檢驗(yàn)報(bào)告(報(bào)告編號006)中& 纖芯直徑,、長度& 、& 光纖傳輸效率& ,、& 光纖傳輸效率不穩(wěn)定度& 的測試結(jié)果為& 符合& ,,但相應(yīng)的檢驗(yàn)原始記錄中無實(shí)際檢測數(shù)據(jù)。 |
| 6 | 抽查企業(yè)的生產(chǎn)批號為1805QGH29A01(滅菌批號為18E00429B-1)的產(chǎn)品檢驗(yàn)報(bào)告,,EO殘留量,、無菌的出廠檢驗(yàn)所用樣品為滅菌替代品,,但《EO殘留量檢驗(yàn)操作規(guī)程》、《無菌檢驗(yàn)操作規(guī)程》規(guī)定抽取12個產(chǎn)品組件替代品(EO殘留量2個,、無菌10個)進(jìn)行檢驗(yàn),,未明確具體組件替代品。 |
| 7 |
1.產(chǎn)品技術(shù)要求中規(guī)定直徑,、后頂焦度測量按GB/T11417規(guī)定的方法進(jìn)行,,國標(biāo)中明確規(guī)定,直徑測量時& 將鏡片放在測池內(nèi),,維持測池內(nèi)標(biāo)準(zhǔn)鹽溶液的溫度為20℃±0.5℃,。轉(zhuǎn)動鏡片,3次獨(dú)立測量最大和最小直徑& ,;后頂焦度測量時& 在測量前,,水凝膠鏡片浸入20℃±0.5℃的標(biāo)準(zhǔn)鹽溶液中平衡至少30min。& ?,F(xiàn)場核查企業(yè)測量時使用常溫純化水代替標(biāo)準(zhǔn)鹽溶液,,與企業(yè)產(chǎn)品技術(shù)要求規(guī)定不符; 2.企業(yè)提供的成品檢驗(yàn)規(guī)程中性能指標(biāo)有5.5無菌要求,、5.7保存液滲透壓,,抽查出廠檢測報(bào)告(生產(chǎn)批號20180720、20180719)中缺少無菌,、保存液滲透壓檢測項(xiàng)目,。抽查出廠檢驗(yàn)報(bào)告(生產(chǎn)批號20170518)無菌檢測項(xiàng)目判定為合格,而未提供相應(yīng)的原始無菌檢測記錄,。 |
| 8 | 二氧化碳激光治療機(jī)注冊產(chǎn)品標(biāo)準(zhǔn)規(guī)定產(chǎn)品瞄準(zhǔn)光波長應(yīng)為635nm±20nm,,但企業(yè)未根據(jù)此要求制定相應(yīng)檢驗(yàn)規(guī)范,且未配備相應(yīng)檢測設(shè)備,。 |
| 9 | 1.舊版的硅凝膠乳房植入體成品檢驗(yàn)規(guī)程未包含殼體D4,、D5,硅凝膠小分子殘留物質(zhì),、邊緣夾角檢驗(yàn)項(xiàng)目,。2.企業(yè)2018年6月對檢驗(yàn)規(guī)程進(jìn)行了修訂,修訂后的檢驗(yàn)規(guī)程未包含該產(chǎn)品技術(shù)要求中的2.4乳房植入體成品性能& 邊緣夾角& 指標(biāo),。 |
| 10 |
1.企業(yè)出具的一次性使用無菌陰道擴(kuò)張器的出廠檢驗(yàn)報(bào)告& 中抗變形能力& 項(xiàng)目均為& 符合要求& ,,但未見該項(xiàng)目檢驗(yàn)原始記錄。 2.抽查2018年生產(chǎn)的擴(kuò)張器批檢驗(yàn)記錄,,批號71804002,、71805002產(chǎn)品檢驗(yàn)報(bào)告依據(jù)為& YY 0336-2002& (現(xiàn)行版本為YY 0336-2013);批號71803009,、71806003產(chǎn)品檢驗(yàn)報(bào)告依據(jù)為& 產(chǎn)品技術(shù)要求& ,,產(chǎn)品技術(shù)要求中無菌的試驗(yàn)方法GB/T14233.2-2005,YY 0336-2013中無菌試驗(yàn)方法為《中國藥典》,。企業(yè)的試驗(yàn)方法不一致。 |
| 11 | 產(chǎn)品出廠檢驗(yàn)報(bào)告(批號170329 編號170329-001)中的檢驗(yàn)項(xiàng)目與產(chǎn)品出廠檢驗(yàn)規(guī)程不一致,,缺少檢驗(yàn)規(guī)程中& 工作情況檢驗(yàn)& 5.1的檢驗(yàn)項(xiàng)目,。 |
| 12 | 產(chǎn)品檢測時部分項(xiàng)目未依據(jù)YY0300—2009《牙科學(xué) 修復(fù)用人工牙》標(biāo)準(zhǔn)進(jìn)行:孔隙和其他缺陷項(xiàng)目,標(biāo)準(zhǔn)規(guī)定試樣制備時應(yīng)采用低速鋸或濕研磨裝置在冷卻條件下截取平面,,實(shí)際使用陶瓷砂輪干法磨削截取平面,;色澤及融合性項(xiàng)目,未按標(biāo)準(zhǔn)規(guī)定布置反射率(30±5)%的漫射灰背景等測試條件進(jìn)行檢查 |







