潤寶醫(yī)療網(wǎng)4月16日訊 日前,,四川匯宇制藥以仿制4類申報的注射用硼替佐米,、鹽酸帕洛諾司瓊注射液上市申請獲得CDE承辦受理,,至今公司已有11個注射劑以新注冊分類報產(chǎn),,其中6個在歐盟獲批上市,,轉報國內并納入/擬納入優(yōu)先審評,此外還有3個歐盟上市注射劑待轉報國內,。11個注射劑中有3個獲批生產(chǎn)并視同過評,,培美曲塞為首批4+7品種,借助獨家中標優(yōu)勢,,匯宇制藥市場份額激增,;在審的8大注射劑中,,匯宇制藥的普樂沙福注射液有望以首仿+過評獲批上市。 比肩恒瑞,、中生,,3大品種領跑注射劑過評榜 圖:過評注射劑品種數(shù)達2個及以上的企業(yè)(以集團計)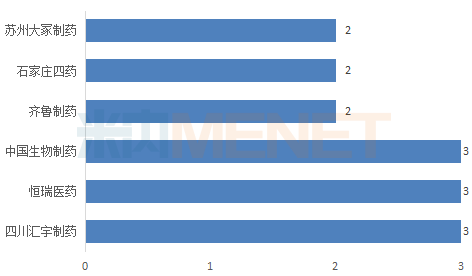 米內網(wǎng)數(shù)據(jù)顯示,目前有企業(yè)通過或視同通過一致性評價的注射劑有46個受理號(以藥品名稱計,,共30個品種),,涉及26家企業(yè)(以集團計),其中有6家企業(yè)過評注射劑品種數(shù)達2個及以上,,匯宇制藥,、恒瑞醫(yī)藥、中國生物制藥以3個過評品種并列榜首,,涉及的受理號分別為7個,、3個、3個,。 表1:匯宇制藥已過評品種
米內網(wǎng)數(shù)據(jù)顯示,目前有企業(yè)通過或視同通過一致性評價的注射劑有46個受理號(以藥品名稱計,,共30個品種),,涉及26家企業(yè)(以集團計),其中有6家企業(yè)過評注射劑品種數(shù)達2個及以上,,匯宇制藥,、恒瑞醫(yī)藥、中國生物制藥以3個過評品種并列榜首,,涉及的受理號分別為7個,、3個、3個,。 表1:匯宇制藥已過評品種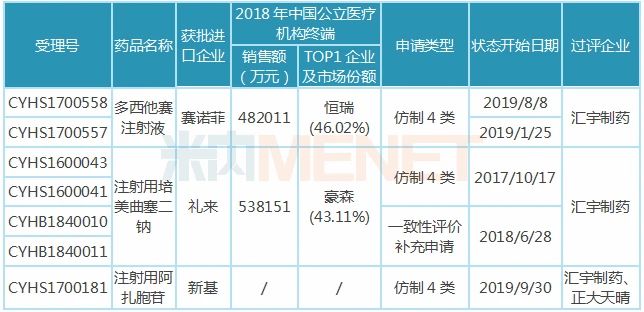 匯宇制藥已過評的3款注射劑均為抗腫瘤藥,,米內網(wǎng)數(shù)據(jù)顯示,2018年中國城市公立醫(yī)院,、縣級公立醫(yī)院,、城市社區(qū)中心以及鄉(xiāng)鎮(zhèn)衛(wèi)生院(簡稱中國公立醫(yī)療機構)終端抗腫瘤化藥產(chǎn)品競爭格局中,注射用培美曲塞二鈉,、多西他賽注射液分別以6.77%,、6.06%市場份額排位第一、第二,。 3款注射劑中,,注射用培美曲塞二鈉被納入第一批4+7帶量采購,作為該品種唯一過評企業(yè),,匯宇制藥成功中標,。在集采之前,培美曲塞市場主要由豪森,、齊魯及禮來占領,,帶量采購助力“光腳企業(yè)”匯宇制藥銷量迅速上升,搶占市場份額,。 米內網(wǎng)數(shù)據(jù)顯示,,2019年重點城市公立醫(yī)院化學藥終端(樣本覆蓋北京、哈爾濱,、長春,、沈陽、天津,、石家莊,、太原,、廣州、深圳,、鄭州,、重慶、武漢,、長沙,、上海、濟南,、杭州、南京,、福州,、成都、西安20個城市,,其中9個為4+7試點城市)注射用培美曲塞二鈉廠家競爭格局中,,匯宇制藥排位第三(銷售額同比增長32509.46%),僅次于豪森,、齊魯,。憑借獨家中標的優(yōu)勢,匯宇制藥的市場份額由2018年的0.06%上升至2019年的19.87%,。2019年9月開展的4+7擴面集采,,匯宇制藥與禮來中選,銷量有望再上新臺階,。 注射用阿扎胞苷過評企業(yè)包括匯宇制藥及正大天晴,,大概率入選第三批國家集采,而多西他賽注射液目前雖僅匯宇制藥獨家過評,,但已有4家藥企按仿制4類報產(chǎn),,6家藥企提交一致性評價補充申請,不日將誕生第二家過評企業(yè),。隨著國家?guī)Я坎少彽牟粩嗤七M,,“光腳企業(yè)”匯宇制藥或將持續(xù)受益。 8大注射劑在審,,與揚子江,、齊魯?shù)冉讳h 4月8日、4月10日,,四川匯宇制藥以仿制4類提交的鹽酸帕洛諾司瓊注射液,、注射用硼替佐米上市申請獲得CDE承辦受理,至今公司已按新注冊分類提交11個注射劑上市申請(3個已獲批),。這11個注射劑中,,有6個揚子江已布局,,齊魯、正大天晴,、恒瑞均布局了5個,。 表2:四川匯宇制藥新注冊分類報產(chǎn)且暫未獲批的品種
匯宇制藥已過評的3款注射劑均為抗腫瘤藥,,米內網(wǎng)數(shù)據(jù)顯示,2018年中國城市公立醫(yī)院,、縣級公立醫(yī)院,、城市社區(qū)中心以及鄉(xiāng)鎮(zhèn)衛(wèi)生院(簡稱中國公立醫(yī)療機構)終端抗腫瘤化藥產(chǎn)品競爭格局中,注射用培美曲塞二鈉,、多西他賽注射液分別以6.77%,、6.06%市場份額排位第一、第二,。 3款注射劑中,,注射用培美曲塞二鈉被納入第一批4+7帶量采購,作為該品種唯一過評企業(yè),,匯宇制藥成功中標,。在集采之前,培美曲塞市場主要由豪森,、齊魯及禮來占領,,帶量采購助力“光腳企業(yè)”匯宇制藥銷量迅速上升,搶占市場份額,。 米內網(wǎng)數(shù)據(jù)顯示,,2019年重點城市公立醫(yī)院化學藥終端(樣本覆蓋北京、哈爾濱,、長春,、沈陽、天津,、石家莊,、太原,、廣州、深圳,、鄭州,、重慶、武漢,、長沙,、上海、濟南,、杭州、南京,、福州,、成都、西安20個城市,,其中9個為4+7試點城市)注射用培美曲塞二鈉廠家競爭格局中,,匯宇制藥排位第三(銷售額同比增長32509.46%),僅次于豪森,、齊魯,。憑借獨家中標的優(yōu)勢,匯宇制藥的市場份額由2018年的0.06%上升至2019年的19.87%,。2019年9月開展的4+7擴面集采,,匯宇制藥與禮來中選,銷量有望再上新臺階,。 注射用阿扎胞苷過評企業(yè)包括匯宇制藥及正大天晴,,大概率入選第三批國家集采,而多西他賽注射液目前雖僅匯宇制藥獨家過評,,但已有4家藥企按仿制4類報產(chǎn),,6家藥企提交一致性評價補充申請,不日將誕生第二家過評企業(yè),。隨著國家?guī)Я坎少彽牟粩嗤七M,,“光腳企業(yè)”匯宇制藥或將持續(xù)受益。 8大注射劑在審,,與揚子江,、齊魯?shù)冉讳h 4月8日、4月10日,,四川匯宇制藥以仿制4類提交的鹽酸帕洛諾司瓊注射液,、注射用硼替佐米上市申請獲得CDE承辦受理,至今公司已按新注冊分類提交11個注射劑上市申請(3個已獲批),。這11個注射劑中,,有6個揚子江已布局,,齊魯、正大天晴,、恒瑞均布局了5個,。 表2:四川匯宇制藥新注冊分類報產(chǎn)且暫未獲批的品種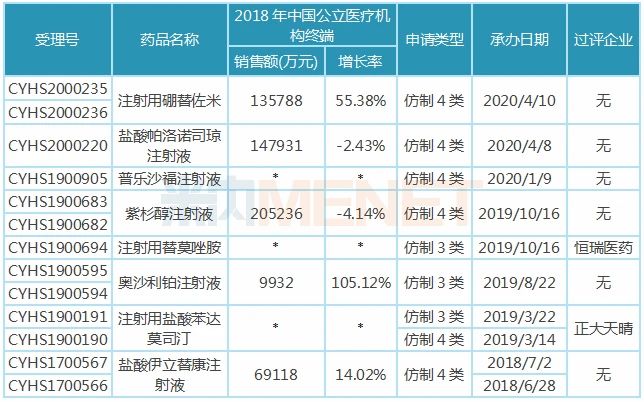 注:銷售額低于3000萬用符號*代表 在審的8大注射劑中,除了鹽酸帕洛諾司瓊注射液為止吐止惡心藥外,,其余7個注射劑均為抗腫瘤藥,,紫杉醇注射液、注射用硼替佐米年銷均超10億元,,在2018年中國公立醫(yī)療機構終端抗腫瘤化藥產(chǎn)品競爭格局中,,分別以2.58%、1.71%排在第16,、17位,。 注射用替莫唑胺、注射用鹽酸苯達莫司汀已有企業(yè)過評,,恒瑞醫(yī)藥打破了替莫唑胺注射劑型在國內市場的空白局面,;正大天晴的注射用鹽酸苯達莫司汀以首仿+過評的方式獲批上市。 表3:匯宇制藥已報產(chǎn)且未有企業(yè)過評的品種
注:銷售額低于3000萬用符號*代表 在審的8大注射劑中,除了鹽酸帕洛諾司瓊注射液為止吐止惡心藥外,,其余7個注射劑均為抗腫瘤藥,,紫杉醇注射液、注射用硼替佐米年銷均超10億元,,在2018年中國公立醫(yī)療機構終端抗腫瘤化藥產(chǎn)品競爭格局中,,分別以2.58%、1.71%排在第16,、17位,。 注射用替莫唑胺、注射用鹽酸苯達莫司汀已有企業(yè)過評,,恒瑞醫(yī)藥打破了替莫唑胺注射劑型在國內市場的空白局面,;正大天晴的注射用鹽酸苯達莫司汀以首仿+過評的方式獲批上市。 表3:匯宇制藥已報產(chǎn)且未有企業(yè)過評的品種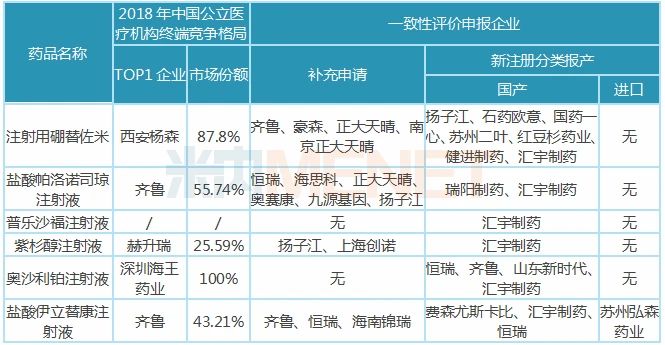 暫無企業(yè)過評的6大注射劑中,,普樂沙福注射液未有首仿獲批,,該產(chǎn)品由賽諾菲旗下的健贊制藥研發(fā),于2008年12月獲得FDA批準上市,,2018年12月獲批進入國內市場,。匯宇制藥獨家申報,有望以首仿+過評獲批上市,。 匯宇制藥的紫杉醇注射液以新注冊分類報產(chǎn),,雖然還有揚子江、上海創(chuàng)諾提交該產(chǎn)品一致性評價補充申請,,但匯宇制藥的產(chǎn)品由國外轉報國內且納入優(yōu)先審評,,從申報進展看,匯宇制藥首家過評的幾率還是很大的,。 6個注射劑彎道超車,,這3個待轉報國內 匯宇制藥秉承成為國際化制藥企業(yè)的愿景,歷經(jīng)多年發(fā)展,,國際化布局卓有成效,,2014年成為中國第一家通過英國GMP認證的抗腫瘤注射劑生產(chǎn)企業(yè);2015年成為中國第一家以自主品牌的注射劑在歐美發(fā)達國家銷售的企業(yè)...... 目前公司有9個注射劑在歐盟國家獲批上市,,分別為注射用鹽酸苯達莫司汀,、多西他賽注射液、鹽酸多柔比星注射液、鹽酸伊立替康注射液,、奧沙利鉑注射液,、紫杉醇注射液、注射用培美曲塞二鈉,、唑來膦酸注射液及鹽酸表柔比星注射液,。 表4:匯宇制藥納入/擬納入優(yōu)先審評品種
暫無企業(yè)過評的6大注射劑中,,普樂沙福注射液未有首仿獲批,,該產(chǎn)品由賽諾菲旗下的健贊制藥研發(fā),于2008年12月獲得FDA批準上市,,2018年12月獲批進入國內市場,。匯宇制藥獨家申報,有望以首仿+過評獲批上市,。 匯宇制藥的紫杉醇注射液以新注冊分類報產(chǎn),,雖然還有揚子江、上海創(chuàng)諾提交該產(chǎn)品一致性評價補充申請,,但匯宇制藥的產(chǎn)品由國外轉報國內且納入優(yōu)先審評,,從申報進展看,匯宇制藥首家過評的幾率還是很大的,。 6個注射劑彎道超車,,這3個待轉報國內 匯宇制藥秉承成為國際化制藥企業(yè)的愿景,歷經(jīng)多年發(fā)展,,國際化布局卓有成效,,2014年成為中國第一家通過英國GMP認證的抗腫瘤注射劑生產(chǎn)企業(yè);2015年成為中國第一家以自主品牌的注射劑在歐美發(fā)達國家銷售的企業(yè)...... 目前公司有9個注射劑在歐盟國家獲批上市,,分別為注射用鹽酸苯達莫司汀,、多西他賽注射液、鹽酸多柔比星注射液、鹽酸伊立替康注射液,、奧沙利鉑注射液,、紫杉醇注射液、注射用培美曲塞二鈉,、唑來膦酸注射液及鹽酸表柔比星注射液,。 表4:匯宇制藥納入/擬納入優(yōu)先審評品種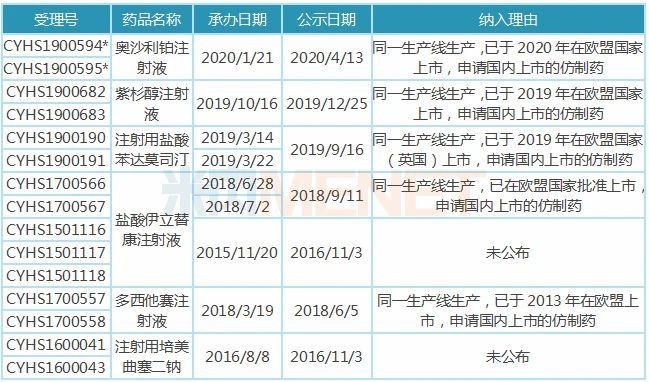 注:帶*為擬優(yōu)先審評 9個注射劑有6個已在國內申報上市,其中5個品種(13個受理號)納入優(yōu)先審評,,1個品種(2個受理號)擬納入優(yōu)先審評,,納入理由為同一生產(chǎn)線生產(chǎn),已在歐盟國家上市,,申請國內上市的仿制藥,,多西他賽、培美曲塞已順利獲批并視同過評,。 表5:匯宇制藥已在歐盟上市但未在國內報產(chǎn)的品種
注:帶*為擬優(yōu)先審評 9個注射劑有6個已在國內申報上市,其中5個品種(13個受理號)納入優(yōu)先審評,,1個品種(2個受理號)擬納入優(yōu)先審評,,納入理由為同一生產(chǎn)線生產(chǎn),已在歐盟國家上市,,申請國內上市的仿制藥,,多西他賽、培美曲塞已順利獲批并視同過評,。 表5:匯宇制藥已在歐盟上市但未在國內報產(chǎn)的品種 鹽酸多柔比星注射液,、鹽酸表柔比星注射液、唑來膦酸注射液3個品種已在歐盟獲批,,匯宇制藥一旦在國內提交上市申請,將大概率納入優(yōu)先審評,,實現(xiàn)彎道超車,。米內網(wǎng)數(shù)據(jù)顯示,2018年中國公立醫(yī)療機構終端多柔比星,、表柔比星,、唑來膦酸銷售額分別為26.85億元、10.37億元,、20.02億元,。 來源:米內網(wǎng)數(shù)據(jù)庫、公司官網(wǎng) 注:數(shù)據(jù)統(tǒng)計截至4月15日,,如有疏漏,,歡迎指正!
鹽酸多柔比星注射液,、鹽酸表柔比星注射液、唑來膦酸注射液3個品種已在歐盟獲批,,匯宇制藥一旦在國內提交上市申請,將大概率納入優(yōu)先審評,,實現(xiàn)彎道超車,。米內網(wǎng)數(shù)據(jù)顯示,2018年中國公立醫(yī)療機構終端多柔比星,、表柔比星,、唑來膦酸銷售額分別為26.85億元、10.37億元,、20.02億元,。 來源:米內網(wǎng)數(shù)據(jù)庫、公司官網(wǎng) 注:數(shù)據(jù)統(tǒng)計截至4月15日,,如有疏漏,,歡迎指正!
 米內網(wǎng)數(shù)據(jù)顯示,目前有企業(yè)通過或視同通過一致性評價的注射劑有46個受理號(以藥品名稱計,,共30個品種),,涉及26家企業(yè)(以集團計),其中有6家企業(yè)過評注射劑品種數(shù)達2個及以上,,匯宇制藥,、恒瑞醫(yī)藥、中國生物制藥以3個過評品種并列榜首,,涉及的受理號分別為7個,、3個、3個,。 表1:匯宇制藥已過評品種
米內網(wǎng)數(shù)據(jù)顯示,目前有企業(yè)通過或視同通過一致性評價的注射劑有46個受理號(以藥品名稱計,,共30個品種),,涉及26家企業(yè)(以集團計),其中有6家企業(yè)過評注射劑品種數(shù)達2個及以上,,匯宇制藥,、恒瑞醫(yī)藥、中國生物制藥以3個過評品種并列榜首,,涉及的受理號分別為7個,、3個、3個,。 表1:匯宇制藥已過評品種 匯宇制藥已過評的3款注射劑均為抗腫瘤藥,,米內網(wǎng)數(shù)據(jù)顯示,2018年中國城市公立醫(yī)院,、縣級公立醫(yī)院,、城市社區(qū)中心以及鄉(xiāng)鎮(zhèn)衛(wèi)生院(簡稱中國公立醫(yī)療機構)終端抗腫瘤化藥產(chǎn)品競爭格局中,注射用培美曲塞二鈉,、多西他賽注射液分別以6.77%,、6.06%市場份額排位第一、第二,。 3款注射劑中,,注射用培美曲塞二鈉被納入第一批4+7帶量采購,作為該品種唯一過評企業(yè),,匯宇制藥成功中標,。在集采之前,培美曲塞市場主要由豪森,、齊魯及禮來占領,,帶量采購助力“光腳企業(yè)”匯宇制藥銷量迅速上升,搶占市場份額,。 米內網(wǎng)數(shù)據(jù)顯示,,2019年重點城市公立醫(yī)院化學藥終端(樣本覆蓋北京、哈爾濱,、長春,、沈陽、天津,、石家莊,、太原,、廣州、深圳,、鄭州,、重慶、武漢,、長沙,、上海、濟南,、杭州、南京,、福州,、成都、西安20個城市,,其中9個為4+7試點城市)注射用培美曲塞二鈉廠家競爭格局中,,匯宇制藥排位第三(銷售額同比增長32509.46%),僅次于豪森,、齊魯,。憑借獨家中標的優(yōu)勢,匯宇制藥的市場份額由2018年的0.06%上升至2019年的19.87%,。2019年9月開展的4+7擴面集采,,匯宇制藥與禮來中選,銷量有望再上新臺階,。 注射用阿扎胞苷過評企業(yè)包括匯宇制藥及正大天晴,,大概率入選第三批國家集采,而多西他賽注射液目前雖僅匯宇制藥獨家過評,,但已有4家藥企按仿制4類報產(chǎn),,6家藥企提交一致性評價補充申請,不日將誕生第二家過評企業(yè),。隨著國家?guī)Я坎少彽牟粩嗤七M,,“光腳企業(yè)”匯宇制藥或將持續(xù)受益。 8大注射劑在審,,與揚子江,、齊魯?shù)冉讳h 4月8日、4月10日,,四川匯宇制藥以仿制4類提交的鹽酸帕洛諾司瓊注射液,、注射用硼替佐米上市申請獲得CDE承辦受理,至今公司已按新注冊分類提交11個注射劑上市申請(3個已獲批),。這11個注射劑中,,有6個揚子江已布局,,齊魯、正大天晴,、恒瑞均布局了5個,。 表2:四川匯宇制藥新注冊分類報產(chǎn)且暫未獲批的品種
匯宇制藥已過評的3款注射劑均為抗腫瘤藥,,米內網(wǎng)數(shù)據(jù)顯示,2018年中國城市公立醫(yī)院,、縣級公立醫(yī)院,、城市社區(qū)中心以及鄉(xiāng)鎮(zhèn)衛(wèi)生院(簡稱中國公立醫(yī)療機構)終端抗腫瘤化藥產(chǎn)品競爭格局中,注射用培美曲塞二鈉,、多西他賽注射液分別以6.77%,、6.06%市場份額排位第一、第二,。 3款注射劑中,,注射用培美曲塞二鈉被納入第一批4+7帶量采購,作為該品種唯一過評企業(yè),,匯宇制藥成功中標,。在集采之前,培美曲塞市場主要由豪森,、齊魯及禮來占領,,帶量采購助力“光腳企業(yè)”匯宇制藥銷量迅速上升,搶占市場份額,。 米內網(wǎng)數(shù)據(jù)顯示,,2019年重點城市公立醫(yī)院化學藥終端(樣本覆蓋北京、哈爾濱,、長春,、沈陽、天津,、石家莊,、太原,、廣州、深圳,、鄭州,、重慶、武漢,、長沙,、上海、濟南,、杭州、南京,、福州,、成都、西安20個城市,,其中9個為4+7試點城市)注射用培美曲塞二鈉廠家競爭格局中,,匯宇制藥排位第三(銷售額同比增長32509.46%),僅次于豪森,、齊魯,。憑借獨家中標的優(yōu)勢,匯宇制藥的市場份額由2018年的0.06%上升至2019年的19.87%,。2019年9月開展的4+7擴面集采,,匯宇制藥與禮來中選,銷量有望再上新臺階,。 注射用阿扎胞苷過評企業(yè)包括匯宇制藥及正大天晴,,大概率入選第三批國家集采,而多西他賽注射液目前雖僅匯宇制藥獨家過評,,但已有4家藥企按仿制4類報產(chǎn),,6家藥企提交一致性評價補充申請,不日將誕生第二家過評企業(yè),。隨著國家?guī)Я坎少彽牟粩嗤七M,,“光腳企業(yè)”匯宇制藥或將持續(xù)受益。 8大注射劑在審,,與揚子江,、齊魯?shù)冉讳h 4月8日、4月10日,,四川匯宇制藥以仿制4類提交的鹽酸帕洛諾司瓊注射液,、注射用硼替佐米上市申請獲得CDE承辦受理,至今公司已按新注冊分類提交11個注射劑上市申請(3個已獲批),。這11個注射劑中,,有6個揚子江已布局,,齊魯、正大天晴,、恒瑞均布局了5個,。 表2:四川匯宇制藥新注冊分類報產(chǎn)且暫未獲批的品種 注:銷售額低于3000萬用符號*代表 在審的8大注射劑中,除了鹽酸帕洛諾司瓊注射液為止吐止惡心藥外,,其余7個注射劑均為抗腫瘤藥,,紫杉醇注射液、注射用硼替佐米年銷均超10億元,,在2018年中國公立醫(yī)療機構終端抗腫瘤化藥產(chǎn)品競爭格局中,,分別以2.58%、1.71%排在第16,、17位,。 注射用替莫唑胺、注射用鹽酸苯達莫司汀已有企業(yè)過評,,恒瑞醫(yī)藥打破了替莫唑胺注射劑型在國內市場的空白局面,;正大天晴的注射用鹽酸苯達莫司汀以首仿+過評的方式獲批上市。 表3:匯宇制藥已報產(chǎn)且未有企業(yè)過評的品種
注:銷售額低于3000萬用符號*代表 在審的8大注射劑中,除了鹽酸帕洛諾司瓊注射液為止吐止惡心藥外,,其余7個注射劑均為抗腫瘤藥,,紫杉醇注射液、注射用硼替佐米年銷均超10億元,,在2018年中國公立醫(yī)療機構終端抗腫瘤化藥產(chǎn)品競爭格局中,,分別以2.58%、1.71%排在第16,、17位,。 注射用替莫唑胺、注射用鹽酸苯達莫司汀已有企業(yè)過評,,恒瑞醫(yī)藥打破了替莫唑胺注射劑型在國內市場的空白局面,;正大天晴的注射用鹽酸苯達莫司汀以首仿+過評的方式獲批上市。 表3:匯宇制藥已報產(chǎn)且未有企業(yè)過評的品種 暫無企業(yè)過評的6大注射劑中,,普樂沙福注射液未有首仿獲批,,該產(chǎn)品由賽諾菲旗下的健贊制藥研發(fā),于2008年12月獲得FDA批準上市,,2018年12月獲批進入國內市場,。匯宇制藥獨家申報,有望以首仿+過評獲批上市,。 匯宇制藥的紫杉醇注射液以新注冊分類報產(chǎn),,雖然還有揚子江、上海創(chuàng)諾提交該產(chǎn)品一致性評價補充申請,,但匯宇制藥的產(chǎn)品由國外轉報國內且納入優(yōu)先審評,,從申報進展看,匯宇制藥首家過評的幾率還是很大的,。 6個注射劑彎道超車,,這3個待轉報國內 匯宇制藥秉承成為國際化制藥企業(yè)的愿景,歷經(jīng)多年發(fā)展,,國際化布局卓有成效,,2014年成為中國第一家通過英國GMP認證的抗腫瘤注射劑生產(chǎn)企業(yè);2015年成為中國第一家以自主品牌的注射劑在歐美發(fā)達國家銷售的企業(yè)...... 目前公司有9個注射劑在歐盟國家獲批上市,,分別為注射用鹽酸苯達莫司汀,、多西他賽注射液、鹽酸多柔比星注射液、鹽酸伊立替康注射液,、奧沙利鉑注射液,、紫杉醇注射液、注射用培美曲塞二鈉,、唑來膦酸注射液及鹽酸表柔比星注射液,。 表4:匯宇制藥納入/擬納入優(yōu)先審評品種
暫無企業(yè)過評的6大注射劑中,,普樂沙福注射液未有首仿獲批,,該產(chǎn)品由賽諾菲旗下的健贊制藥研發(fā),于2008年12月獲得FDA批準上市,,2018年12月獲批進入國內市場,。匯宇制藥獨家申報,有望以首仿+過評獲批上市,。 匯宇制藥的紫杉醇注射液以新注冊分類報產(chǎn),,雖然還有揚子江、上海創(chuàng)諾提交該產(chǎn)品一致性評價補充申請,,但匯宇制藥的產(chǎn)品由國外轉報國內且納入優(yōu)先審評,,從申報進展看,匯宇制藥首家過評的幾率還是很大的,。 6個注射劑彎道超車,,這3個待轉報國內 匯宇制藥秉承成為國際化制藥企業(yè)的愿景,歷經(jīng)多年發(fā)展,,國際化布局卓有成效,,2014年成為中國第一家通過英國GMP認證的抗腫瘤注射劑生產(chǎn)企業(yè);2015年成為中國第一家以自主品牌的注射劑在歐美發(fā)達國家銷售的企業(yè)...... 目前公司有9個注射劑在歐盟國家獲批上市,,分別為注射用鹽酸苯達莫司汀,、多西他賽注射液、鹽酸多柔比星注射液、鹽酸伊立替康注射液,、奧沙利鉑注射液,、紫杉醇注射液、注射用培美曲塞二鈉,、唑來膦酸注射液及鹽酸表柔比星注射液,。 表4:匯宇制藥納入/擬納入優(yōu)先審評品種 注:帶*為擬優(yōu)先審評 9個注射劑有6個已在國內申報上市,其中5個品種(13個受理號)納入優(yōu)先審評,,1個品種(2個受理號)擬納入優(yōu)先審評,,納入理由為同一生產(chǎn)線生產(chǎn),已在歐盟國家上市,,申請國內上市的仿制藥,,多西他賽、培美曲塞已順利獲批并視同過評,。 表5:匯宇制藥已在歐盟上市但未在國內報產(chǎn)的品種
注:帶*為擬優(yōu)先審評 9個注射劑有6個已在國內申報上市,其中5個品種(13個受理號)納入優(yōu)先審評,,1個品種(2個受理號)擬納入優(yōu)先審評,,納入理由為同一生產(chǎn)線生產(chǎn),已在歐盟國家上市,,申請國內上市的仿制藥,,多西他賽、培美曲塞已順利獲批并視同過評,。 表5:匯宇制藥已在歐盟上市但未在國內報產(chǎn)的品種 鹽酸多柔比星注射液,、鹽酸表柔比星注射液、唑來膦酸注射液3個品種已在歐盟獲批,,匯宇制藥一旦在國內提交上市申請,將大概率納入優(yōu)先審評,,實現(xiàn)彎道超車,。米內網(wǎng)數(shù)據(jù)顯示,2018年中國公立醫(yī)療機構終端多柔比星,、表柔比星,、唑來膦酸銷售額分別為26.85億元、10.37億元,、20.02億元,。 來源:米內網(wǎng)數(shù)據(jù)庫、公司官網(wǎng) 注:數(shù)據(jù)統(tǒng)計截至4月15日,,如有疏漏,,歡迎指正!
鹽酸多柔比星注射液,、鹽酸表柔比星注射液、唑來膦酸注射液3個品種已在歐盟獲批,,匯宇制藥一旦在國內提交上市申請,將大概率納入優(yōu)先審評,,實現(xiàn)彎道超車,。米內網(wǎng)數(shù)據(jù)顯示,2018年中國公立醫(yī)療機構終端多柔比星,、表柔比星,、唑來膦酸銷售額分別為26.85億元、10.37億元,、20.02億元,。 來源:米內網(wǎng)數(shù)據(jù)庫、公司官網(wǎng) 注:數(shù)據(jù)統(tǒng)計截至4月15日,,如有疏漏,,歡迎指正!



