潤寶醫(yī)療網(wǎng)5月26日訊 2020 年 5 月 14 日,,注射劑一致性評價正式啟動,,意料之中的事情似乎并不意外,,只是給國內(nèi)眾多注射劑文號持有企業(yè)吃了一顆定心丸,。 注射劑一致性評價目前啟動率僅3% 據(jù) Insight 數(shù)據(jù)庫統(tǒng)計,以劑型為注射劑,、注射用微球,、注射用脂質(zhì)體、注射用乳劑,、注射用微乳,,上市文號在使用,,藥品類型為化學(xué)仿制藥,搜索上市藥品數(shù)據(jù)庫,,共有 30667 個文號(涉及企業(yè) 1000 家)需要開展一致性評價(未剔除氯化鈉注射液等不需要開展一致性評價的品種),;截止 5 月 14 日,已通過/視同通過一致性評價,、遞交補充申請、BE 試驗中,、備案參比和申報參比的共有 1010 個(按文號統(tǒng)計),,注射劑一致性評價的啟動率僅 3% 左右。 或許之前因為技術(shù)文件未公布,、參比制劑未公布,,企業(yè)遲遲不肯動工,但是據(jù) Insight 數(shù)據(jù)庫統(tǒng)計(https://db.dxy.cn/v5),,目前在國家藥監(jiān)局已發(fā)布的正式版的參比制劑目錄中,,篩選劑型為注射劑、注射用微球,、注射用脂質(zhì)體,、注射用乳劑、注射用微乳,,共包括 849 個注射劑參比制劑,,其中也包括一些特殊注射劑。所以,,萬事俱備只欠東風(fēng),,注射劑仿制藥淘汰賽開始加速。  圖片來源:Insight 數(shù)據(jù)庫 31 個品種通過/視同通過一致性評價 在目前已過評的 31 個注射劑品種中,,只有海南普利制藥的注射用阿奇霉素通過一致性評價,,其余均為視同通過;且這 31 個品種中已有注射用培美曲塞二鈉,、氟比洛芬酯注射液,、右美托咪定注射液、注射用紫杉醇(白蛋白結(jié)合型)進入國家?guī)Я坎少彙?nbsp;
圖片來源:Insight 數(shù)據(jù)庫 31 個品種通過/視同通過一致性評價 在目前已過評的 31 個注射劑品種中,,只有海南普利制藥的注射用阿奇霉素通過一致性評價,,其余均為視同通過;且這 31 個品種中已有注射用培美曲塞二鈉,、氟比洛芬酯注射液,、右美托咪定注射液、注射用紫杉醇(白蛋白結(jié)合型)進入國家?guī)Я坎少彙?nbsp;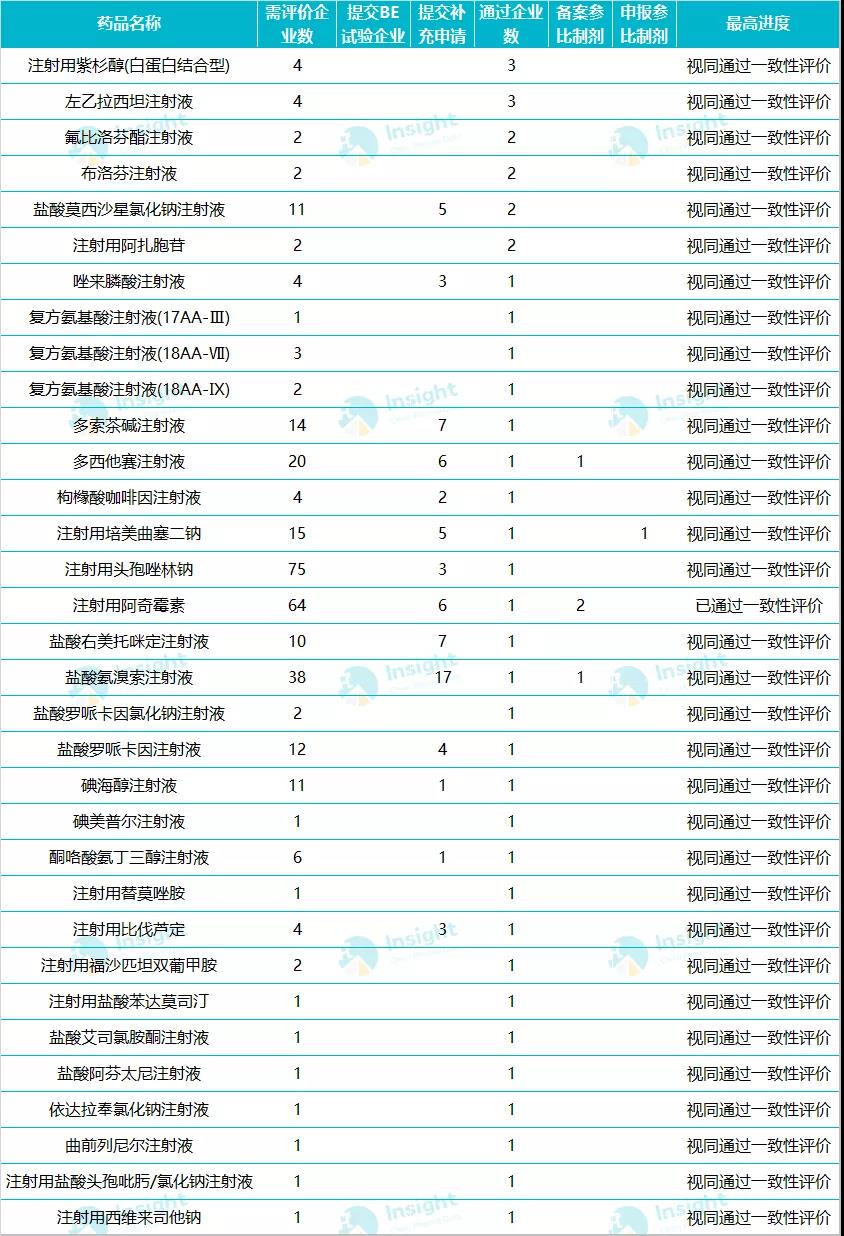 數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 過評品種詳情▼ 備注:數(shù)據(jù)庫顯示 33 個品種,,是按照藥品名稱統(tǒng)計,,此處復(fù)方氨基酸注射液 Ⅲ、Ⅸ,、Ⅶ 3 個規(guī)格統(tǒng)計為 1 個品種,。 135 個品種已遞交補充申請,是通過還是駁回,? 在 Insight 數(shù)據(jù)庫申報進度庫中,,篩選劑型為注射劑,、注射用微球、注射用脂質(zhì)體,、注射用乳劑,、注射用微乳發(fā)現(xiàn),目前遞交一致性評價補充申請的共有 723 個受理號(涉及品種 135 個),,其中 1 個已獲批通過一致性評價(海南普利的注射用阿奇霉素),,1 個批準開展臨床(廣東嘉博制藥的丙泊酚中/長鏈脂肪乳注射液),最要緊的是還有 718 個受理號遞交注射劑一致性評價補充申請后尚未取得審評結(jié)論,。 遞交一致性評價補充申請最多的品種
數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 過評品種詳情▼ 備注:數(shù)據(jù)庫顯示 33 個品種,,是按照藥品名稱統(tǒng)計,,此處復(fù)方氨基酸注射液 Ⅲ、Ⅸ,、Ⅶ 3 個規(guī)格統(tǒng)計為 1 個品種,。 135 個品種已遞交補充申請,是通過還是駁回,? 在 Insight 數(shù)據(jù)庫申報進度庫中,,篩選劑型為注射劑,、注射用微球、注射用脂質(zhì)體,、注射用乳劑,、注射用微乳發(fā)現(xiàn),目前遞交一致性評價補充申請的共有 723 個受理號(涉及品種 135 個),,其中 1 個已獲批通過一致性評價(海南普利的注射用阿奇霉素),,1 個批準開展臨床(廣東嘉博制藥的丙泊酚中/長鏈脂肪乳注射液),最要緊的是還有 718 個受理號遞交注射劑一致性評價補充申請后尚未取得審評結(jié)論,。 遞交一致性評價補充申請最多的品種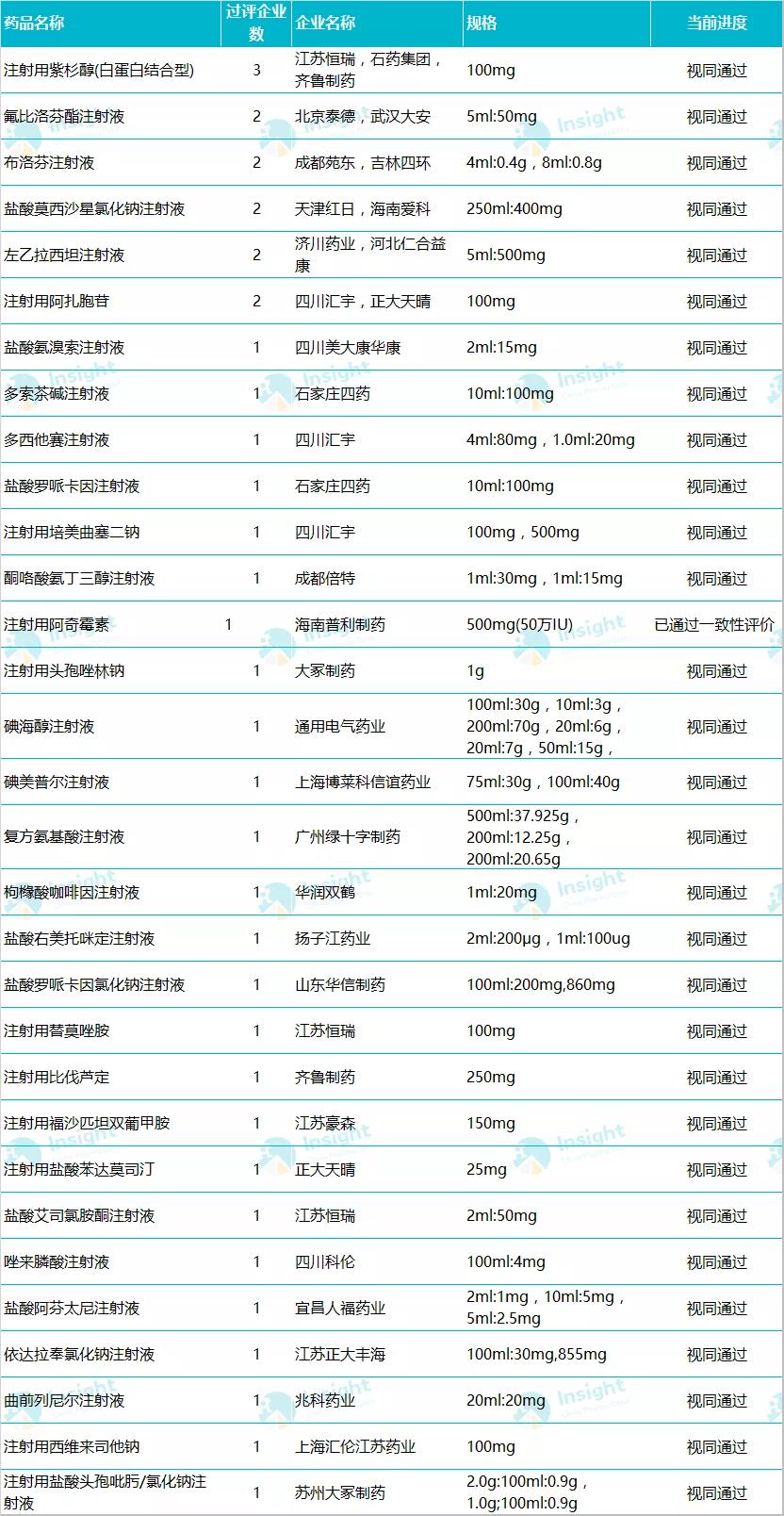 數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 在這 718 個受理號中,,最早的是在 2018 年遞交一致性評價補充申請,但當(dāng)時,,注射劑一致性評價尚處于征求意見階段,,對于此階段企業(yè)開展的注射劑一致性評價,國家藥監(jiān)局如何做審評結(jié)論我們也十分期待,。 早在 2017 年 12 月,,CDE 發(fā)布《已上市化學(xué)仿制藥(注射劑)一致性評價技術(shù)要求》并公開征求意見; 2019 年 3 月 28 日,,在 CDE 發(fā)布的第 21 批參比制劑目錄中,,首次出現(xiàn)注射劑參比制劑,共包括 224 個,,一是引起業(yè)內(nèi)騷動,; 2019 年 10 月,國家藥監(jiān)局發(fā)布《化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評價技術(shù)要求(征求意見稿)》和申報資料征求意見稿,; 2019 年 11 月,,CDE 又公布《特殊注射劑質(zhì)量和療效一致性評價技術(shù)要求(征求意見稿)》; 2020 年 5 月 14 日,,注射劑一致性評價技術(shù)文件落地,,標志著注射劑一致性評價全面啟動。 在 718 個遞交一致性評價的受理號中,,數(shù)量較多的企業(yè)有科倫藥業(yè),、揚子江、齊魯制藥,、中國生物制藥,、恒瑞等,涉及品種均超過 10 個,。
數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 在這 718 個受理號中,,最早的是在 2018 年遞交一致性評價補充申請,但當(dāng)時,,注射劑一致性評價尚處于征求意見階段,,對于此階段企業(yè)開展的注射劑一致性評價,國家藥監(jiān)局如何做審評結(jié)論我們也十分期待,。 早在 2017 年 12 月,,CDE 發(fā)布《已上市化學(xué)仿制藥(注射劑)一致性評價技術(shù)要求》并公開征求意見; 2019 年 3 月 28 日,,在 CDE 發(fā)布的第 21 批參比制劑目錄中,,首次出現(xiàn)注射劑參比制劑,共包括 224 個,,一是引起業(yè)內(nèi)騷動,; 2019 年 10 月,國家藥監(jiān)局發(fā)布《化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評價技術(shù)要求(征求意見稿)》和申報資料征求意見稿,; 2019 年 11 月,,CDE 又公布《特殊注射劑質(zhì)量和療效一致性評價技術(shù)要求(征求意見稿)》; 2020 年 5 月 14 日,,注射劑一致性評價技術(shù)文件落地,,標志著注射劑一致性評價全面啟動。 在 718 個遞交一致性評價的受理號中,,數(shù)量較多的企業(yè)有科倫藥業(yè),、揚子江、齊魯制藥,、中國生物制藥,、恒瑞等,涉及品種均超過 10 個,。 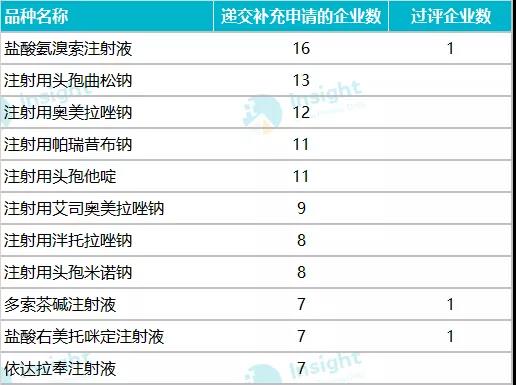 數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 按照 CDE 承辦的時間來看,,2018 年承辦的受理號共 142 個,2019 年承辦 415 個,;按照國家藥監(jiān)局最新發(fā)布的《關(guān)于開展化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評價工作的公告》要求:審評工作應(yīng)當(dāng)在受理后 120 日內(nèi)完成,。經(jīng)審評認為需申請人補充資料的,,申請人應(yīng)在 4 個月內(nèi)一次性完成補充資料。發(fā)補時限不計入審評時限,。由此看來,,2018 年和 2019 年承辦的一致性評價補充申請近期可能會拿到審評結(jié)論。
數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 按照 CDE 承辦的時間來看,,2018 年承辦的受理號共 142 個,2019 年承辦 415 個,;按照國家藥監(jiān)局最新發(fā)布的《關(guān)于開展化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評價工作的公告》要求:審評工作應(yīng)當(dāng)在受理后 120 日內(nèi)完成,。經(jīng)審評認為需申請人補充資料的,,申請人應(yīng)在 4 個月內(nèi)一次性完成補充資料。發(fā)補時限不計入審評時限,。由此看來,,2018 年和 2019 年承辦的一致性評價補充申請近期可能會拿到審評結(jié)論。 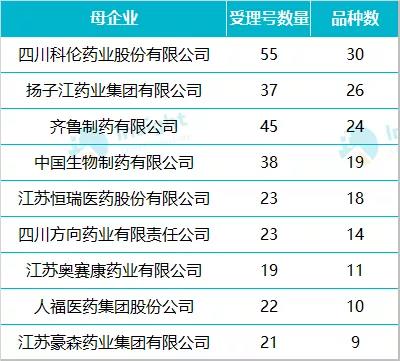 數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 免做一致性評價品種,,已有企業(yè)申報補充申請 在 5 月 14 日 CDE 公布的《化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評價技術(shù)要求》中明確:氯化鈉注射液,、葡萄糖注射液、葡萄糖氯化鈉注射液,、注射用水,、部分放射性藥物(如锝〔99mTc〕)等品種無需開展一致性評價,需進行質(zhì)量提升研究,,滅菌工藝、濾器與包材選擇(含相容性研究)等應(yīng)符合相關(guān)技術(shù)要求,。 Insight 數(shù)據(jù)庫顯示,,在已經(jīng)遞交一致性評價補充申請的品種中,涉及氯化鈉注射液,、葡萄糖氯化鈉注射液,、復(fù)方氯化鈉注射液共有 12 個受理號,包括企業(yè)有科倫藥業(yè),、山東齊都藥業(yè),、石家莊四藥等。不過數(shù)據(jù)庫中未查到這些品種有開展過生物等效性試驗,。
數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 免做一致性評價品種,,已有企業(yè)申報補充申請 在 5 月 14 日 CDE 公布的《化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評價技術(shù)要求》中明確:氯化鈉注射液,、葡萄糖注射液、葡萄糖氯化鈉注射液,、注射用水,、部分放射性藥物(如锝〔99mTc〕)等品種無需開展一致性評價,需進行質(zhì)量提升研究,,滅菌工藝、濾器與包材選擇(含相容性研究)等應(yīng)符合相關(guān)技術(shù)要求,。 Insight 數(shù)據(jù)庫顯示,,在已經(jīng)遞交一致性評價補充申請的品種中,涉及氯化鈉注射液,、葡萄糖氯化鈉注射液,、復(fù)方氯化鈉注射液共有 12 個受理號,包括企業(yè)有科倫藥業(yè),、山東齊都藥業(yè),、石家莊四藥等。不過數(shù)據(jù)庫中未查到這些品種有開展過生物等效性試驗,。 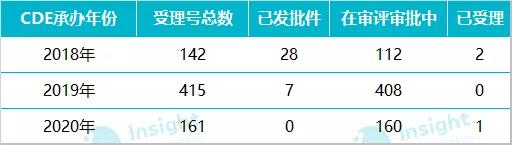 數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 整體來說,,注射劑一致性評價尚在早期,過評品種較少,,如果能夠把握好時間首家過評,,就有可能重演揚子江藥業(yè)右美托咪定注射液在 4+7 集采中的輝煌,逆襲甚至扭轉(zhuǎn)市場格局,;當(dāng)然,,也有可能在集采中淪為炮灰,但是長遠來看,,不做連上戰(zhàn)場的機會都沒有,。 一致性評價就是一場博弈。
數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 整體來說,,注射劑一致性評價尚在早期,過評品種較少,,如果能夠把握好時間首家過評,,就有可能重演揚子江藥業(yè)右美托咪定注射液在 4+7 集采中的輝煌,逆襲甚至扭轉(zhuǎn)市場格局,;當(dāng)然,,也有可能在集采中淪為炮灰,但是長遠來看,,不做連上戰(zhàn)場的機會都沒有,。 一致性評價就是一場博弈。
 圖片來源:Insight 數(shù)據(jù)庫 31 個品種通過/視同通過一致性評價 在目前已過評的 31 個注射劑品種中,,只有海南普利制藥的注射用阿奇霉素通過一致性評價,,其余均為視同通過;且這 31 個品種中已有注射用培美曲塞二鈉,、氟比洛芬酯注射液,、右美托咪定注射液、注射用紫杉醇(白蛋白結(jié)合型)進入國家?guī)Я坎少彙?nbsp;
圖片來源:Insight 數(shù)據(jù)庫 31 個品種通過/視同通過一致性評價 在目前已過評的 31 個注射劑品種中,,只有海南普利制藥的注射用阿奇霉素通過一致性評價,,其余均為視同通過;且這 31 個品種中已有注射用培美曲塞二鈉,、氟比洛芬酯注射液,、右美托咪定注射液、注射用紫杉醇(白蛋白結(jié)合型)進入國家?guī)Я坎少彙?nbsp; 數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 過評品種詳情▼ 備注:數(shù)據(jù)庫顯示 33 個品種,,是按照藥品名稱統(tǒng)計,,此處復(fù)方氨基酸注射液 Ⅲ、Ⅸ,、Ⅶ 3 個規(guī)格統(tǒng)計為 1 個品種,。 135 個品種已遞交補充申請,是通過還是駁回,? 在 Insight 數(shù)據(jù)庫申報進度庫中,,篩選劑型為注射劑,、注射用微球、注射用脂質(zhì)體,、注射用乳劑,、注射用微乳發(fā)現(xiàn),目前遞交一致性評價補充申請的共有 723 個受理號(涉及品種 135 個),,其中 1 個已獲批通過一致性評價(海南普利的注射用阿奇霉素),,1 個批準開展臨床(廣東嘉博制藥的丙泊酚中/長鏈脂肪乳注射液),最要緊的是還有 718 個受理號遞交注射劑一致性評價補充申請后尚未取得審評結(jié)論,。 遞交一致性評價補充申請最多的品種
數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 過評品種詳情▼ 備注:數(shù)據(jù)庫顯示 33 個品種,,是按照藥品名稱統(tǒng)計,,此處復(fù)方氨基酸注射液 Ⅲ、Ⅸ,、Ⅶ 3 個規(guī)格統(tǒng)計為 1 個品種,。 135 個品種已遞交補充申請,是通過還是駁回,? 在 Insight 數(shù)據(jù)庫申報進度庫中,,篩選劑型為注射劑,、注射用微球、注射用脂質(zhì)體,、注射用乳劑,、注射用微乳發(fā)現(xiàn),目前遞交一致性評價補充申請的共有 723 個受理號(涉及品種 135 個),,其中 1 個已獲批通過一致性評價(海南普利的注射用阿奇霉素),,1 個批準開展臨床(廣東嘉博制藥的丙泊酚中/長鏈脂肪乳注射液),最要緊的是還有 718 個受理號遞交注射劑一致性評價補充申請后尚未取得審評結(jié)論,。 遞交一致性評價補充申請最多的品種 數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 在這 718 個受理號中,,最早的是在 2018 年遞交一致性評價補充申請,但當(dāng)時,,注射劑一致性評價尚處于征求意見階段,,對于此階段企業(yè)開展的注射劑一致性評價,國家藥監(jiān)局如何做審評結(jié)論我們也十分期待,。 早在 2017 年 12 月,,CDE 發(fā)布《已上市化學(xué)仿制藥(注射劑)一致性評價技術(shù)要求》并公開征求意見; 2019 年 3 月 28 日,,在 CDE 發(fā)布的第 21 批參比制劑目錄中,,首次出現(xiàn)注射劑參比制劑,共包括 224 個,,一是引起業(yè)內(nèi)騷動,; 2019 年 10 月,國家藥監(jiān)局發(fā)布《化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評價技術(shù)要求(征求意見稿)》和申報資料征求意見稿,; 2019 年 11 月,,CDE 又公布《特殊注射劑質(zhì)量和療效一致性評價技術(shù)要求(征求意見稿)》; 2020 年 5 月 14 日,,注射劑一致性評價技術(shù)文件落地,,標志著注射劑一致性評價全面啟動。 在 718 個遞交一致性評價的受理號中,,數(shù)量較多的企業(yè)有科倫藥業(yè),、揚子江、齊魯制藥,、中國生物制藥,、恒瑞等,涉及品種均超過 10 個,。
數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 在這 718 個受理號中,,最早的是在 2018 年遞交一致性評價補充申請,但當(dāng)時,,注射劑一致性評價尚處于征求意見階段,,對于此階段企業(yè)開展的注射劑一致性評價,國家藥監(jiān)局如何做審評結(jié)論我們也十分期待,。 早在 2017 年 12 月,,CDE 發(fā)布《已上市化學(xué)仿制藥(注射劑)一致性評價技術(shù)要求》并公開征求意見; 2019 年 3 月 28 日,,在 CDE 發(fā)布的第 21 批參比制劑目錄中,,首次出現(xiàn)注射劑參比制劑,共包括 224 個,,一是引起業(yè)內(nèi)騷動,; 2019 年 10 月,國家藥監(jiān)局發(fā)布《化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評價技術(shù)要求(征求意見稿)》和申報資料征求意見稿,; 2019 年 11 月,,CDE 又公布《特殊注射劑質(zhì)量和療效一致性評價技術(shù)要求(征求意見稿)》; 2020 年 5 月 14 日,,注射劑一致性評價技術(shù)文件落地,,標志著注射劑一致性評價全面啟動。 在 718 個遞交一致性評價的受理號中,,數(shù)量較多的企業(yè)有科倫藥業(yè),、揚子江、齊魯制藥,、中國生物制藥,、恒瑞等,涉及品種均超過 10 個,。  數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 按照 CDE 承辦的時間來看,,2018 年承辦的受理號共 142 個,2019 年承辦 415 個,;按照國家藥監(jiān)局最新發(fā)布的《關(guān)于開展化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評價工作的公告》要求:審評工作應(yīng)當(dāng)在受理后 120 日內(nèi)完成,。經(jīng)審評認為需申請人補充資料的,,申請人應(yīng)在 4 個月內(nèi)一次性完成補充資料。發(fā)補時限不計入審評時限,。由此看來,,2018 年和 2019 年承辦的一致性評價補充申請近期可能會拿到審評結(jié)論。
數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 按照 CDE 承辦的時間來看,,2018 年承辦的受理號共 142 個,2019 年承辦 415 個,;按照國家藥監(jiān)局最新發(fā)布的《關(guān)于開展化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評價工作的公告》要求:審評工作應(yīng)當(dāng)在受理后 120 日內(nèi)完成,。經(jīng)審評認為需申請人補充資料的,,申請人應(yīng)在 4 個月內(nèi)一次性完成補充資料。發(fā)補時限不計入審評時限,。由此看來,,2018 年和 2019 年承辦的一致性評價補充申請近期可能會拿到審評結(jié)論。  數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 免做一致性評價品種,,已有企業(yè)申報補充申請 在 5 月 14 日 CDE 公布的《化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評價技術(shù)要求》中明確:氯化鈉注射液,、葡萄糖注射液、葡萄糖氯化鈉注射液,、注射用水,、部分放射性藥物(如锝〔99mTc〕)等品種無需開展一致性評價,需進行質(zhì)量提升研究,,滅菌工藝、濾器與包材選擇(含相容性研究)等應(yīng)符合相關(guān)技術(shù)要求,。 Insight 數(shù)據(jù)庫顯示,,在已經(jīng)遞交一致性評價補充申請的品種中,涉及氯化鈉注射液,、葡萄糖氯化鈉注射液,、復(fù)方氯化鈉注射液共有 12 個受理號,包括企業(yè)有科倫藥業(yè),、山東齊都藥業(yè),、石家莊四藥等。不過數(shù)據(jù)庫中未查到這些品種有開展過生物等效性試驗,。
數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 免做一致性評價品種,,已有企業(yè)申報補充申請 在 5 月 14 日 CDE 公布的《化學(xué)藥品注射劑仿制藥質(zhì)量和療效一致性評價技術(shù)要求》中明確:氯化鈉注射液,、葡萄糖注射液、葡萄糖氯化鈉注射液,、注射用水,、部分放射性藥物(如锝〔99mTc〕)等品種無需開展一致性評價,需進行質(zhì)量提升研究,,滅菌工藝、濾器與包材選擇(含相容性研究)等應(yīng)符合相關(guān)技術(shù)要求,。 Insight 數(shù)據(jù)庫顯示,,在已經(jīng)遞交一致性評價補充申請的品種中,涉及氯化鈉注射液,、葡萄糖氯化鈉注射液,、復(fù)方氯化鈉注射液共有 12 個受理號,包括企業(yè)有科倫藥業(yè),、山東齊都藥業(yè),、石家莊四藥等。不過數(shù)據(jù)庫中未查到這些品種有開展過生物等效性試驗,。  數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 整體來說,,注射劑一致性評價尚在早期,過評品種較少,,如果能夠把握好時間首家過評,,就有可能重演揚子江藥業(yè)右美托咪定注射液在 4+7 集采中的輝煌,逆襲甚至扭轉(zhuǎn)市場格局,;當(dāng)然,,也有可能在集采中淪為炮灰,但是長遠來看,,不做連上戰(zhàn)場的機會都沒有,。 一致性評價就是一場博弈。
數(shù)據(jù)來源:Insight 數(shù)據(jù)庫 整體來說,,注射劑一致性評價尚在早期,過評品種較少,,如果能夠把握好時間首家過評,,就有可能重演揚子江藥業(yè)右美托咪定注射液在 4+7 集采中的輝煌,逆襲甚至扭轉(zhuǎn)市場格局,;當(dāng)然,,也有可能在集采中淪為炮灰,但是長遠來看,,不做連上戰(zhàn)場的機會都沒有,。 一致性評價就是一場博弈。



