潤(rùn)寶醫(yī)療網(wǎng)3月15日訊 全球累計(jì)在阿爾茲海默病上的研發(fā)投入超過(guò)6000億,,失敗的臨床藥物超過(guò)300種,失敗率超過(guò)99%,,羅氏,、禮來(lái)、默沙東,、阿斯利康都曾在這一領(lǐng)域折戟,。即便如此,,恒瑞還是選擇了“往前再邁一步”,開(kāi)始嘗試探索更具創(chuàng)新性,、風(fēng)險(xiǎn)性的新領(lǐng)域了,。 3月10日,恒瑞醫(yī)藥SHR-1707臨床試驗(yàn)申請(qǐng)獲得藥監(jiān)局默示許可,,用于治療阿爾茨海默?。ˋD)。據(jù)了解,,SHR-1707臨床試驗(yàn)申請(qǐng)最早于2020年12月23日提交,,彼時(shí)并未披露靶點(diǎn)。 根據(jù)國(guó)家知識(shí)產(chǎn)權(quán)局官網(wǎng)披露,,可判斷恒瑞醫(yī)藥SHR-1707是抗Abeta(Aβ,,β-淀粉樣蛋白)抗體。這是目前恒瑞唯一公布的一款靶向β淀粉樣蛋白(Aβ)的發(fā)明,,從專(zhuān)利申請(qǐng)時(shí)間來(lái)看,,恒瑞至少2019年7月前就已經(jīng)開(kāi)始布局阿爾茨海默病的藥物研發(fā)。  一般情況下,,在新藥臨床試驗(yàn)申請(qǐng)(IND)前,,需要經(jīng)歷臨床前研究階段,此階段包括研究開(kāi)發(fā)和臨床前實(shí)驗(yàn)兩部分,,一般需要耗費(fèi)(4~7年),。如果是跟隨靶點(diǎn),由于不涉及靶點(diǎn)發(fā)現(xiàn),,時(shí)間會(huì)縮短,。以此推算,恒瑞最早可能在2015年左右就開(kāi)始了研究,。 而全球關(guān)于Aβ的研究需要追溯至上世紀(jì)90年代,,由于人類(lèi)對(duì)于阿爾茲海默病的發(fā)病原因和機(jī)理制并不完全清楚,藥物研發(fā)都基于各種假說(shuō)理論,,有學(xué)者就提出類(lèi)淀粉蛋白假說(shuō),,認(rèn)為可能是Aβ在大腦堆積導(dǎo)致阿爾茨海默病。也有一些研究數(shù)據(jù)體現(xiàn)了阿爾茨海默病嚴(yán)重程度與患者大腦中Aβ斑塊沉積有關(guān)性,。 但由于沒(méi)有 Aβ沉積與阿爾茲海默病患者認(rèn)知能力下降之間存在因果關(guān)系的確切證據(jù),,Aβ沉積假說(shuō)被認(rèn)為缺少作為藥物研發(fā)理論依據(jù)。在長(zhǎng)達(dá)近30的AD研發(fā)史中,,針對(duì) Aβ沉積的藥物無(wú)一成功,,Aducanumab的出現(xiàn)既讓人興奮,又備受爭(zhēng)議。 Aducanumab的研發(fā)歷程就像眾多藥企奮戰(zhàn)阿爾茨海默的一個(gè)縮影,,屢敗屢戰(zhàn),、前赴后繼。美國(guó)藥物生產(chǎn)與研發(fā)協(xié)會(huì)數(shù)據(jù)顯示,,全球累計(jì)在阿爾茲海默病上的研發(fā)投入超過(guò)6000億美元,,失敗的臨床藥物超過(guò)300種,,失敗率超過(guò)99%,,F(xiàn)DA已經(jīng)有17年未批準(zhǔn)針對(duì)阿爾茨海默氏病的藥物治療藥物。 2016年9月Aducanumab遇到令人沮喪的障礙,,彼時(shí)距離渤健啟動(dòng)兩項(xiàng)關(guān)于Aducanumab對(duì)AD的治療效果的III期臨床已經(jīng)一年,,通過(guò)患者腦部掃描分析結(jié)果表明該試驗(yàn)“不太可能達(dá)到主要終點(diǎn)”。 但渤健并沒(méi)有放棄,,選擇了繼續(xù)開(kāi)發(fā),。在太平洋彼岸,受益于新藥審評(píng)審批制度的改革推進(jìn),,國(guó)內(nèi)創(chuàng)新藥正在漸次萌芽,,特別是很早便覺(jué)醒要做創(chuàng)新轉(zhuǎn)型的恒瑞,前途未明的Aβ或許就是在這樣的背景下漂洋過(guò)海來(lái)到中國(guó),。 不過(guò),,Aducanumab還是沒(méi)能逃過(guò)前輩們的宿命。2019年3月,,渤健宣布終止Aducanumab的III期臨床試驗(yàn),。彼時(shí)恒瑞實(shí)驗(yàn)室對(duì)于Aβ的研究已經(jīng)是如火如荼,接近提交成果的時(shí)刻,,4個(gè)月后恒瑞在國(guó)家知識(shí)產(chǎn)權(quán)局提交的專(zhuān)利申請(qǐng)通過(guò),。 雖然宣布終止,但僅僅半年時(shí)間Aducanumab“啟思會(huì)上”,。2019年10月,,渤健表示通過(guò)增大患者數(shù)量并對(duì)數(shù)據(jù)重新進(jìn)行分析后發(fā)現(xiàn)高劑量(10mg/kg)的Aducanumab能夠顯著改善患者認(rèn)知能力, 因此宣布重新啟動(dòng)對(duì)Aducanumab的申請(qǐng)程序,,并計(jì)劃遞交BLA,。 雖然爭(zhēng)議仍在,F(xiàn)DA成為這場(chǎng)研發(fā)競(jìng)賽的“關(guān)鍵先生”,。 2020年8月,,F(xiàn)DA宣布已接受阿爾茨海默病在研藥物Aducanumab的BLA,并授予其優(yōu)先審查資格,,預(yù)計(jì)將于2021年3月7日做出審批決定,。美國(guó)媒體評(píng)價(jià)FDA此舉顯示其有意愿回應(yīng)市場(chǎng)對(duì)阿爾茲海默病的需求。 就在故事似乎要朝著“蓋棺定論”的方向發(fā)展之時(shí),變數(shù)再生,。 2020年11月,,F(xiàn)DA外部專(zhuān)家組成的咨詢委員會(huì)對(duì)Aducanumab說(shuō)了NO。盡管聽(tīng)證會(huì)上FDA不斷表示向外部專(zhuān)家組證明Aducanumab的有效性的,,但11人組成的專(zhuān)家組僅1人投票贊成,,8人反對(duì)其余專(zhuān)家則投出了棄權(quán)票。有專(zhuān)家表示理解阿爾茨海默癥的重要性和急迫性,,但如果因此就批準(zhǔn)一種無(wú)效藥物,,不僅對(duì)患者毫無(wú)益處,也對(duì)制藥行業(yè)發(fā)出錯(cuò)誤信號(hào),。 外界對(duì)Aducanumab的態(tài)度又變得消極起來(lái),。有華爾街分析師稱(chēng),在專(zhuān)家組如此表態(tài)下如果Aducanumab仍獲得批準(zhǔn),,那只能說(shuō)明“要么藥物無(wú)效分析無(wú)關(guān)緊要,,要么統(tǒng)計(jì)數(shù)據(jù)無(wú)關(guān)緊要,要么專(zhuān)家組投票結(jié)果無(wú)關(guān)緊要,。” 不過(guò),,第三次反轉(zhuǎn)來(lái)得更快。 2020年1月底,,渤健與衛(wèi)材聯(lián)合宣布,,F(xiàn)DA已將aducanumab的BLA審查期延長(zhǎng)了3個(gè)月。并且有消息傳出FDA將擴(kuò)大外部專(zhuān)家組的人數(shù),,以尋求“更多理解”,。市場(chǎng)也嗅到了FDA推進(jìn)aducanumab的“決心”,渤建股價(jià)一度攀升10%,,但在最終的博弈之下漲幅回落至5.62%,。 直到今天,Aducanumab能否獲批上市還未知,。 01 屢敗屢戰(zhàn),,MNC決戰(zhàn)AD 三十年中,向阿爾茨海默,、向失敗挑戰(zhàn)的遠(yuǎn)不止渤健,,還有前赴后繼的國(guó)際大藥企,盡管很多無(wú)功而返,,甚至耗費(fèi)了巨資,。 2012年,強(qiáng)生/輝瑞的單抗藥物Bapineuzumab臨床III期試驗(yàn)慘遭失敗,,福布斯的專(zhuān)欄文章評(píng)論道:“輝瑞和強(qiáng)生應(yīng)該進(jìn)行前瞻性試驗(yàn),,以驗(yàn)證β淀粉樣蛋白的清除對(duì)阿爾茨海默病治療的影響,,而不是進(jìn)行一系列可能耗資4億美元甚至更多的大規(guī)模試驗(yàn)。研發(fā)資金是寶貴的,,不應(yīng)浪費(fèi)在一廂情愿的想法上,。” 2014年,羅氏的AD藥物Gantenerumab也宣告失敗,,外媒在一項(xiàng)關(guān)于Gantenerumab和Solanezumab的臨床失敗報(bào)道中,,稱(chēng)一個(gè)藥物從idea到批準(zhǔn),大約需要12年,,而這項(xiàng)AD領(lǐng)域的研究可能超過(guò),,并且耗費(fèi)了約26億美元; 2016年,,扎根AD領(lǐng)域31年的禮來(lái)在該領(lǐng)域投入的30億美元,,隨著Solanezumab的III期臨床試驗(yàn)數(shù)據(jù)未達(dá)預(yù)期而付之東流,; 2017年,,默沙東宣布停止開(kāi)發(fā)減低β-淀粉樣蛋白的藥物Verubecestat; 2018年,,禮來(lái)/阿斯利康宣布終止治療阿爾茨海默病藥物lanabecestat全球多個(gè)III期臨床試驗(yàn),。 雖然阿爾茨海默病讓眾多國(guó)際大藥企無(wú)功而返,但也正因?yàn)槠潆y度大,、市場(chǎng)廣依舊吸引著大小藥企,、科研機(jī)構(gòu)布局。 根據(jù)國(guó)際阿爾茨海默病協(xié)會(huì)統(tǒng)計(jì),,全球已有超過(guò)5000萬(wàn)癡呆患者,,其中70%由阿爾茨海默病引起。隨著世界人口持續(xù)老年化,,該數(shù)字可能在2050年增至三倍,。Zion Market Research報(bào)告顯示,預(yù)計(jì)到2024年全球阿爾茨海默病藥物市場(chǎng)將達(dá)到56.6億美元,。這也讓中外生物制藥企業(yè)紛紛瞄準(zhǔn)阿爾茨海默病研發(fā)新藥,。 國(guó)家知識(shí)產(chǎn)權(quán)局官網(wǎng)顯示,國(guó)內(nèi)阿爾茨海默病相關(guān)專(zhuān)利超1800項(xiàng),。其中綠谷制藥在2019年前后申請(qǐng)了多項(xiàng)與阿爾茨海默病相關(guān)的專(zhuān)利,。作為“填補(bǔ)了過(guò)去17年阿爾茨海默癥治療領(lǐng)域無(wú)新藥上市的空白”的國(guó)產(chǎn)新藥,上海藥物所,、中國(guó)海洋大學(xué),、上海綠谷制藥聯(lián)合開(kāi)發(fā)的甘露特鈉(GV-971,商品名九期一®)自上市以來(lái)備受關(guān)注,。雖然這款藥此前備受爭(zhēng)議,,但并不影響其上市不久即賣(mài)斷貨,。今年2月,九期一®已在美國(guó)臨床研究中心完成Ⅲ期臨床試驗(yàn)首例患者給藥,,預(yù)計(jì)在2025年完成國(guó)際臨床試驗(yàn)的52周雙盲期研究計(jì)劃,,之后綠谷制藥將開(kāi)展歐美地區(qū)的新藥注冊(cè)上市工作。 除了已上市的九期一®外,,國(guó)內(nèi)外目前還未有真正意義上可減緩阿爾茨海默病病情的藥物上市,。由于阿爾茨海默病發(fā)病機(jī)理復(fù)雜,病因至今未明,,所以依舊是“世界難題”,。而在“正確答案”公布之前,不同的公司也根據(jù)不同的假說(shuō)用不同的方式試圖“解答”,。 2021年1月,,禮來(lái)宣布其靶向N3pG-β淀粉樣蛋白抗體藥物Donanemab治療早期阿爾茨海默病II期臨床研究(TRAILBLAZER-ALZ)達(dá)到主要終點(diǎn)。結(jié)果顯示,,Donanemab可顯著減緩早期阿爾茲海默病疾病進(jìn)展,,患者認(rèn)知和日常功能復(fù)合指標(biāo)(iADRS)下降較安慰劑減緩32%。 在2018年宣布停止阿爾茨海默病藥物研發(fā)之后,,2020年輝瑞又選擇與IBM合作,,共同打造人工智能(AI)模型以幫助人們預(yù)測(cè)阿爾茨海默病的發(fā)作。從藥物研發(fā)轉(zhuǎn)向預(yù)測(cè),、診斷,,也是一種新的“解題思路”。 與輝瑞“解題思路”相似的還有羅氏,。2020年,,羅氏公司旗下的基因泰克與其合作伙伴ACImmune公司聯(lián)合研發(fā)的靶向Tau淀粉樣蛋白抗體藥物Semorinemab的II期臨床試驗(yàn)未達(dá)到主要終點(diǎn)及兩個(gè)次要終點(diǎn)。研發(fā)受挫之后,,羅氏將目光轉(zhuǎn)向了量子計(jì)算機(jī)方向,。2021年,羅氏公司與英國(guó)劍橋量子計(jì)算公司(CambridgeQuantumComputing)合作,,計(jì)劃使用量子計(jì)算機(jī)軟件平臺(tái)來(lái)模擬量子層級(jí)的化學(xué)相互作用,,從而研發(fā)阿爾茨海默病的治療方法。 除了靶向β淀粉樣蛋白或Tau淀粉樣蛋白外,,還有一些機(jī)構(gòu)選擇從基因入手,,想從基因的角度來(lái)預(yù)防阿爾茨海默病。APOE4基因長(zhǎng)期以來(lái)被認(rèn)為是導(dǎo)致阿爾茨海默病的一個(gè)危險(xiǎn)因素,,所以包括麻省理工學(xué)院,、康奈爾大學(xué)威爾醫(yī)學(xué)院等著名院校在內(nèi)的研究機(jī)構(gòu)正試圖用CRISPR等基因編輯技術(shù)來(lái)改變APOE4基因,從而避免阿爾茨海默病的發(fā)生,。 解答一個(gè)“未解”但市場(chǎng)巨大的難題,,遠(yuǎn)比多答已有答案的題要艱難,、費(fèi)力得多,但這也是創(chuàng)新者們更想走的路,。 02 從仿制藥到創(chuàng)新者的冒險(xiǎn) 即便眾多MNC相繼在AD領(lǐng)域折戟,,恒瑞還是選擇了“往前再邁一步”,開(kāi)始嘗試探索更具創(chuàng)新性,、風(fēng)險(xiǎn)性的新領(lǐng)域了,。 復(fù)盤(pán)恒瑞近30年的發(fā)展歷史,其研發(fā)歷程分為三個(gè)階段:
一般情況下,,在新藥臨床試驗(yàn)申請(qǐng)(IND)前,,需要經(jīng)歷臨床前研究階段,此階段包括研究開(kāi)發(fā)和臨床前實(shí)驗(yàn)兩部分,,一般需要耗費(fèi)(4~7年),。如果是跟隨靶點(diǎn),由于不涉及靶點(diǎn)發(fā)現(xiàn),,時(shí)間會(huì)縮短,。以此推算,恒瑞最早可能在2015年左右就開(kāi)始了研究,。 而全球關(guān)于Aβ的研究需要追溯至上世紀(jì)90年代,,由于人類(lèi)對(duì)于阿爾茲海默病的發(fā)病原因和機(jī)理制并不完全清楚,藥物研發(fā)都基于各種假說(shuō)理論,,有學(xué)者就提出類(lèi)淀粉蛋白假說(shuō),,認(rèn)為可能是Aβ在大腦堆積導(dǎo)致阿爾茨海默病。也有一些研究數(shù)據(jù)體現(xiàn)了阿爾茨海默病嚴(yán)重程度與患者大腦中Aβ斑塊沉積有關(guān)性,。 但由于沒(méi)有 Aβ沉積與阿爾茲海默病患者認(rèn)知能力下降之間存在因果關(guān)系的確切證據(jù),,Aβ沉積假說(shuō)被認(rèn)為缺少作為藥物研發(fā)理論依據(jù)。在長(zhǎng)達(dá)近30的AD研發(fā)史中,,針對(duì) Aβ沉積的藥物無(wú)一成功,,Aducanumab的出現(xiàn)既讓人興奮,又備受爭(zhēng)議。 Aducanumab的研發(fā)歷程就像眾多藥企奮戰(zhàn)阿爾茨海默的一個(gè)縮影,,屢敗屢戰(zhàn),、前赴后繼。美國(guó)藥物生產(chǎn)與研發(fā)協(xié)會(huì)數(shù)據(jù)顯示,,全球累計(jì)在阿爾茲海默病上的研發(fā)投入超過(guò)6000億美元,,失敗的臨床藥物超過(guò)300種,,失敗率超過(guò)99%,,F(xiàn)DA已經(jīng)有17年未批準(zhǔn)針對(duì)阿爾茨海默氏病的藥物治療藥物。 2016年9月Aducanumab遇到令人沮喪的障礙,,彼時(shí)距離渤健啟動(dòng)兩項(xiàng)關(guān)于Aducanumab對(duì)AD的治療效果的III期臨床已經(jīng)一年,,通過(guò)患者腦部掃描分析結(jié)果表明該試驗(yàn)“不太可能達(dá)到主要終點(diǎn)”。 但渤健并沒(méi)有放棄,,選擇了繼續(xù)開(kāi)發(fā),。在太平洋彼岸,受益于新藥審評(píng)審批制度的改革推進(jìn),,國(guó)內(nèi)創(chuàng)新藥正在漸次萌芽,,特別是很早便覺(jué)醒要做創(chuàng)新轉(zhuǎn)型的恒瑞,前途未明的Aβ或許就是在這樣的背景下漂洋過(guò)海來(lái)到中國(guó),。 不過(guò),,Aducanumab還是沒(méi)能逃過(guò)前輩們的宿命。2019年3月,,渤健宣布終止Aducanumab的III期臨床試驗(yàn),。彼時(shí)恒瑞實(shí)驗(yàn)室對(duì)于Aβ的研究已經(jīng)是如火如荼,接近提交成果的時(shí)刻,,4個(gè)月后恒瑞在國(guó)家知識(shí)產(chǎn)權(quán)局提交的專(zhuān)利申請(qǐng)通過(guò),。 雖然宣布終止,但僅僅半年時(shí)間Aducanumab“啟思會(huì)上”,。2019年10月,,渤健表示通過(guò)增大患者數(shù)量并對(duì)數(shù)據(jù)重新進(jìn)行分析后發(fā)現(xiàn)高劑量(10mg/kg)的Aducanumab能夠顯著改善患者認(rèn)知能力, 因此宣布重新啟動(dòng)對(duì)Aducanumab的申請(qǐng)程序,,并計(jì)劃遞交BLA,。 雖然爭(zhēng)議仍在,F(xiàn)DA成為這場(chǎng)研發(fā)競(jìng)賽的“關(guān)鍵先生”,。 2020年8月,,F(xiàn)DA宣布已接受阿爾茨海默病在研藥物Aducanumab的BLA,并授予其優(yōu)先審查資格,,預(yù)計(jì)將于2021年3月7日做出審批決定,。美國(guó)媒體評(píng)價(jià)FDA此舉顯示其有意愿回應(yīng)市場(chǎng)對(duì)阿爾茲海默病的需求。 就在故事似乎要朝著“蓋棺定論”的方向發(fā)展之時(shí),變數(shù)再生,。 2020年11月,,F(xiàn)DA外部專(zhuān)家組成的咨詢委員會(huì)對(duì)Aducanumab說(shuō)了NO。盡管聽(tīng)證會(huì)上FDA不斷表示向外部專(zhuān)家組證明Aducanumab的有效性的,,但11人組成的專(zhuān)家組僅1人投票贊成,,8人反對(duì)其余專(zhuān)家則投出了棄權(quán)票。有專(zhuān)家表示理解阿爾茨海默癥的重要性和急迫性,,但如果因此就批準(zhǔn)一種無(wú)效藥物,,不僅對(duì)患者毫無(wú)益處,也對(duì)制藥行業(yè)發(fā)出錯(cuò)誤信號(hào),。 外界對(duì)Aducanumab的態(tài)度又變得消極起來(lái),。有華爾街分析師稱(chēng),在專(zhuān)家組如此表態(tài)下如果Aducanumab仍獲得批準(zhǔn),,那只能說(shuō)明“要么藥物無(wú)效分析無(wú)關(guān)緊要,,要么統(tǒng)計(jì)數(shù)據(jù)無(wú)關(guān)緊要,要么專(zhuān)家組投票結(jié)果無(wú)關(guān)緊要,。” 不過(guò),,第三次反轉(zhuǎn)來(lái)得更快。 2020年1月底,,渤健與衛(wèi)材聯(lián)合宣布,,F(xiàn)DA已將aducanumab的BLA審查期延長(zhǎng)了3個(gè)月。并且有消息傳出FDA將擴(kuò)大外部專(zhuān)家組的人數(shù),,以尋求“更多理解”,。市場(chǎng)也嗅到了FDA推進(jìn)aducanumab的“決心”,渤建股價(jià)一度攀升10%,,但在最終的博弈之下漲幅回落至5.62%,。 直到今天,Aducanumab能否獲批上市還未知,。 01 屢敗屢戰(zhàn),,MNC決戰(zhàn)AD 三十年中,向阿爾茨海默,、向失敗挑戰(zhàn)的遠(yuǎn)不止渤健,,還有前赴后繼的國(guó)際大藥企,盡管很多無(wú)功而返,,甚至耗費(fèi)了巨資,。 2012年,強(qiáng)生/輝瑞的單抗藥物Bapineuzumab臨床III期試驗(yàn)慘遭失敗,,福布斯的專(zhuān)欄文章評(píng)論道:“輝瑞和強(qiáng)生應(yīng)該進(jìn)行前瞻性試驗(yàn),,以驗(yàn)證β淀粉樣蛋白的清除對(duì)阿爾茨海默病治療的影響,,而不是進(jìn)行一系列可能耗資4億美元甚至更多的大規(guī)模試驗(yàn)。研發(fā)資金是寶貴的,,不應(yīng)浪費(fèi)在一廂情愿的想法上,。” 2014年,羅氏的AD藥物Gantenerumab也宣告失敗,,外媒在一項(xiàng)關(guān)于Gantenerumab和Solanezumab的臨床失敗報(bào)道中,,稱(chēng)一個(gè)藥物從idea到批準(zhǔn),大約需要12年,,而這項(xiàng)AD領(lǐng)域的研究可能超過(guò),,并且耗費(fèi)了約26億美元; 2016年,,扎根AD領(lǐng)域31年的禮來(lái)在該領(lǐng)域投入的30億美元,,隨著Solanezumab的III期臨床試驗(yàn)數(shù)據(jù)未達(dá)預(yù)期而付之東流,; 2017年,,默沙東宣布停止開(kāi)發(fā)減低β-淀粉樣蛋白的藥物Verubecestat; 2018年,,禮來(lái)/阿斯利康宣布終止治療阿爾茨海默病藥物lanabecestat全球多個(gè)III期臨床試驗(yàn),。 雖然阿爾茨海默病讓眾多國(guó)際大藥企無(wú)功而返,但也正因?yàn)槠潆y度大,、市場(chǎng)廣依舊吸引著大小藥企,、科研機(jī)構(gòu)布局。 根據(jù)國(guó)際阿爾茨海默病協(xié)會(huì)統(tǒng)計(jì),,全球已有超過(guò)5000萬(wàn)癡呆患者,,其中70%由阿爾茨海默病引起。隨著世界人口持續(xù)老年化,,該數(shù)字可能在2050年增至三倍,。Zion Market Research報(bào)告顯示,預(yù)計(jì)到2024年全球阿爾茨海默病藥物市場(chǎng)將達(dá)到56.6億美元,。這也讓中外生物制藥企業(yè)紛紛瞄準(zhǔn)阿爾茨海默病研發(fā)新藥,。 國(guó)家知識(shí)產(chǎn)權(quán)局官網(wǎng)顯示,國(guó)內(nèi)阿爾茨海默病相關(guān)專(zhuān)利超1800項(xiàng),。其中綠谷制藥在2019年前后申請(qǐng)了多項(xiàng)與阿爾茨海默病相關(guān)的專(zhuān)利,。作為“填補(bǔ)了過(guò)去17年阿爾茨海默癥治療領(lǐng)域無(wú)新藥上市的空白”的國(guó)產(chǎn)新藥,上海藥物所,、中國(guó)海洋大學(xué),、上海綠谷制藥聯(lián)合開(kāi)發(fā)的甘露特鈉(GV-971,商品名九期一®)自上市以來(lái)備受關(guān)注,。雖然這款藥此前備受爭(zhēng)議,,但并不影響其上市不久即賣(mài)斷貨,。今年2月,九期一®已在美國(guó)臨床研究中心完成Ⅲ期臨床試驗(yàn)首例患者給藥,,預(yù)計(jì)在2025年完成國(guó)際臨床試驗(yàn)的52周雙盲期研究計(jì)劃,,之后綠谷制藥將開(kāi)展歐美地區(qū)的新藥注冊(cè)上市工作。 除了已上市的九期一®外,,國(guó)內(nèi)外目前還未有真正意義上可減緩阿爾茨海默病病情的藥物上市,。由于阿爾茨海默病發(fā)病機(jī)理復(fù)雜,病因至今未明,,所以依舊是“世界難題”,。而在“正確答案”公布之前,不同的公司也根據(jù)不同的假說(shuō)用不同的方式試圖“解答”,。 2021年1月,,禮來(lái)宣布其靶向N3pG-β淀粉樣蛋白抗體藥物Donanemab治療早期阿爾茨海默病II期臨床研究(TRAILBLAZER-ALZ)達(dá)到主要終點(diǎn)。結(jié)果顯示,,Donanemab可顯著減緩早期阿爾茲海默病疾病進(jìn)展,,患者認(rèn)知和日常功能復(fù)合指標(biāo)(iADRS)下降較安慰劑減緩32%。 在2018年宣布停止阿爾茨海默病藥物研發(fā)之后,,2020年輝瑞又選擇與IBM合作,,共同打造人工智能(AI)模型以幫助人們預(yù)測(cè)阿爾茨海默病的發(fā)作。從藥物研發(fā)轉(zhuǎn)向預(yù)測(cè),、診斷,,也是一種新的“解題思路”。 與輝瑞“解題思路”相似的還有羅氏,。2020年,,羅氏公司旗下的基因泰克與其合作伙伴ACImmune公司聯(lián)合研發(fā)的靶向Tau淀粉樣蛋白抗體藥物Semorinemab的II期臨床試驗(yàn)未達(dá)到主要終點(diǎn)及兩個(gè)次要終點(diǎn)。研發(fā)受挫之后,,羅氏將目光轉(zhuǎn)向了量子計(jì)算機(jī)方向,。2021年,羅氏公司與英國(guó)劍橋量子計(jì)算公司(CambridgeQuantumComputing)合作,,計(jì)劃使用量子計(jì)算機(jī)軟件平臺(tái)來(lái)模擬量子層級(jí)的化學(xué)相互作用,,從而研發(fā)阿爾茨海默病的治療方法。 除了靶向β淀粉樣蛋白或Tau淀粉樣蛋白外,,還有一些機(jī)構(gòu)選擇從基因入手,,想從基因的角度來(lái)預(yù)防阿爾茨海默病。APOE4基因長(zhǎng)期以來(lái)被認(rèn)為是導(dǎo)致阿爾茨海默病的一個(gè)危險(xiǎn)因素,,所以包括麻省理工學(xué)院,、康奈爾大學(xué)威爾醫(yī)學(xué)院等著名院校在內(nèi)的研究機(jī)構(gòu)正試圖用CRISPR等基因編輯技術(shù)來(lái)改變APOE4基因,從而避免阿爾茨海默病的發(fā)生,。 解答一個(gè)“未解”但市場(chǎng)巨大的難題,,遠(yuǎn)比多答已有答案的題要艱難,、費(fèi)力得多,但這也是創(chuàng)新者們更想走的路,。 02 從仿制藥到創(chuàng)新者的冒險(xiǎn) 即便眾多MNC相繼在AD領(lǐng)域折戟,,恒瑞還是選擇了“往前再邁一步”,開(kāi)始嘗試探索更具創(chuàng)新性,、風(fēng)險(xiǎn)性的新領(lǐng)域了,。 復(fù)盤(pán)恒瑞近30年的發(fā)展歷史,其研發(fā)歷程分為三個(gè)階段: 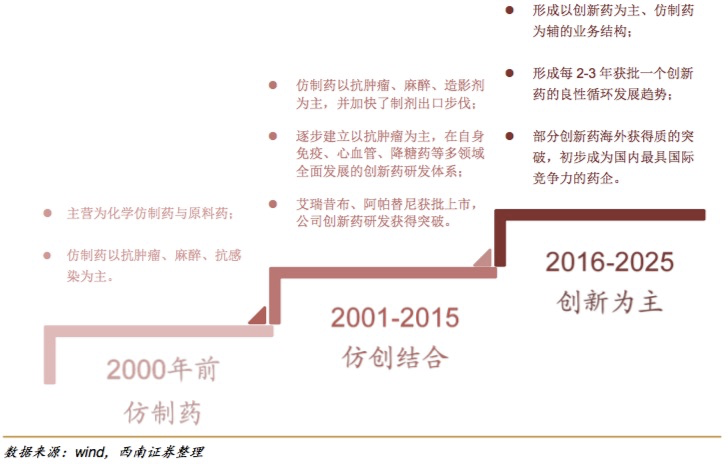 一是仿制藥階段(2000年以前),,主要代表產(chǎn)品為異環(huán)磷酰胺,、多西他賽、伊立替康,、培門(mén)冬酶等,。 異環(huán)磷酰胺算是恒瑞最初的冒險(xiǎn),1992年孫飄揚(yáng)拿120萬(wàn)元,,去北京高校買(mǎi)新藥異環(huán)磷酰胺的專(zhuān)利,,這在當(dāng)時(shí)年利潤(rùn)不達(dá)100萬(wàn)的制藥廠來(lái)說(shuō)簡(jiǎn)直是“天文數(shù)字”。買(mǎi)回來(lái)的只是制造工藝,,臨床效果還未可知,。 1995年,,抗腫瘤藥異環(huán)磷酰胺經(jīng)批準(zhǔn)上市,,恒瑞第一次有了自己的“新藥”。據(jù)悉,,異環(huán)磷酰胺/巰乙磺酸鈉(I/M)于1988年12月首次獲美國(guó)FDA批準(zhǔn)上市,,并被列為最高等級(jí)1A級(jí)抗腫瘤藥。 恒瑞在異環(huán)磷酰胺嘗到了甜頭,,便開(kāi)始籌劃自主創(chuàng)新體系的構(gòu)建,。1992年恒瑞率先在連云港建起了2900平方的研究大樓,2000年投資2億元在上海建立新的研究中心,,2005年恒瑞挺進(jìn)海外,,以300萬(wàn)美元在美國(guó)舊金山籌建海外研究所。 由此恒瑞步入第二階段:仿創(chuàng)結(jié)合階段(2000年~2015年),。約2000年公司開(kāi)始著手創(chuàng)新藥的立項(xiàng)工作,,并于2003 年開(kāi)始第一個(gè)創(chuàng)新藥艾瑞昔布臨床申請(qǐng)。期間,,公司累計(jì)申報(bào)了26個(gè)創(chuàng)新藥的臨床,,艾瑞昔布與阿帕替尼分別于2011、2014 年獲批上市,,公司創(chuàng)新藥研發(fā)獲得階段性突破,,成為國(guó)內(nèi)唯一擁有2 個(gè)“新藥”的國(guó)產(chǎn)藥企,。 阿帕替尼作為恒瑞十年自主研發(fā)的抗腫瘤藥物,自上市以來(lái)銷(xiāo)量持續(xù)走高,,2015年銷(xiāo)售額約3億,,到了2019年銷(xiāo)售額直沖25.31億元,一舉成為恒瑞王牌產(chǎn)品,。加之新適應(yīng)癥獲批,,預(yù)計(jì)2020年阿帕替尼銷(xiāo)售額有望突破30億元。 在經(jīng)歷 2015-2016年臨床數(shù)據(jù)自查,、化學(xué)藥分類(lèi)改革的短期影響后,,恒瑞步入以創(chuàng)新為導(dǎo)向的第三階段。2018年-2020年,,恒瑞先后上市了馬來(lái)酸吡咯替尼片(商品名:艾瑞妮),、卡瑞利珠單抗、甲苯磺酸瑞瑪唑侖,、氟唑帕利膠囊4款重磅新藥,。在創(chuàng)新藥開(kāi)發(fā)上,恒瑞已基本形成每 2-3 年都有創(chuàng)新藥上市的良性發(fā)展態(tài)勢(shì),。 西南證券預(yù)計(jì),,2025年公司有望總計(jì)獲批 10 個(gè)左右的創(chuàng)新藥,創(chuàng)新藥收入有望達(dá)到公司營(yíng)收的 50%,,業(yè)績(jī)占比有望達(dá)到 70%,。個(gè)別創(chuàng)新藥有望在海外取得實(shí)質(zhì)性的突破,初步具備國(guó)際競(jìng)爭(zhēng)力,。 在一系列重大邁步之下,,恒瑞早已從仿制藥走在了Fast-Follow的前列,并且到了不僅僅滿足于Fast-Follow的階段,,其在AD領(lǐng)域的涉足僅僅是恒瑞向更創(chuàng)新其中的典型代表,。
一是仿制藥階段(2000年以前),,主要代表產(chǎn)品為異環(huán)磷酰胺,、多西他賽、伊立替康,、培門(mén)冬酶等,。 異環(huán)磷酰胺算是恒瑞最初的冒險(xiǎn),1992年孫飄揚(yáng)拿120萬(wàn)元,,去北京高校買(mǎi)新藥異環(huán)磷酰胺的專(zhuān)利,,這在當(dāng)時(shí)年利潤(rùn)不達(dá)100萬(wàn)的制藥廠來(lái)說(shuō)簡(jiǎn)直是“天文數(shù)字”。買(mǎi)回來(lái)的只是制造工藝,,臨床效果還未可知,。 1995年,,抗腫瘤藥異環(huán)磷酰胺經(jīng)批準(zhǔn)上市,,恒瑞第一次有了自己的“新藥”。據(jù)悉,,異環(huán)磷酰胺/巰乙磺酸鈉(I/M)于1988年12月首次獲美國(guó)FDA批準(zhǔn)上市,,并被列為最高等級(jí)1A級(jí)抗腫瘤藥。 恒瑞在異環(huán)磷酰胺嘗到了甜頭,,便開(kāi)始籌劃自主創(chuàng)新體系的構(gòu)建,。1992年恒瑞率先在連云港建起了2900平方的研究大樓,2000年投資2億元在上海建立新的研究中心,,2005年恒瑞挺進(jìn)海外,,以300萬(wàn)美元在美國(guó)舊金山籌建海外研究所。 由此恒瑞步入第二階段:仿創(chuàng)結(jié)合階段(2000年~2015年),。約2000年公司開(kāi)始著手創(chuàng)新藥的立項(xiàng)工作,,并于2003 年開(kāi)始第一個(gè)創(chuàng)新藥艾瑞昔布臨床申請(qǐng)。期間,,公司累計(jì)申報(bào)了26個(gè)創(chuàng)新藥的臨床,,艾瑞昔布與阿帕替尼分別于2011、2014 年獲批上市,,公司創(chuàng)新藥研發(fā)獲得階段性突破,,成為國(guó)內(nèi)唯一擁有2 個(gè)“新藥”的國(guó)產(chǎn)藥企,。 阿帕替尼作為恒瑞十年自主研發(fā)的抗腫瘤藥物,自上市以來(lái)銷(xiāo)量持續(xù)走高,,2015年銷(xiāo)售額約3億,,到了2019年銷(xiāo)售額直沖25.31億元,一舉成為恒瑞王牌產(chǎn)品,。加之新適應(yīng)癥獲批,,預(yù)計(jì)2020年阿帕替尼銷(xiāo)售額有望突破30億元。 在經(jīng)歷 2015-2016年臨床數(shù)據(jù)自查,、化學(xué)藥分類(lèi)改革的短期影響后,,恒瑞步入以創(chuàng)新為導(dǎo)向的第三階段。2018年-2020年,,恒瑞先后上市了馬來(lái)酸吡咯替尼片(商品名:艾瑞妮),、卡瑞利珠單抗、甲苯磺酸瑞瑪唑侖,、氟唑帕利膠囊4款重磅新藥,。在創(chuàng)新藥開(kāi)發(fā)上,恒瑞已基本形成每 2-3 年都有創(chuàng)新藥上市的良性發(fā)展態(tài)勢(shì),。 西南證券預(yù)計(jì),,2025年公司有望總計(jì)獲批 10 個(gè)左右的創(chuàng)新藥,創(chuàng)新藥收入有望達(dá)到公司營(yíng)收的 50%,,業(yè)績(jī)占比有望達(dá)到 70%,。個(gè)別創(chuàng)新藥有望在海外取得實(shí)質(zhì)性的突破,初步具備國(guó)際競(jìng)爭(zhēng)力,。 在一系列重大邁步之下,,恒瑞早已從仿制藥走在了Fast-Follow的前列,并且到了不僅僅滿足于Fast-Follow的階段,,其在AD領(lǐng)域的涉足僅僅是恒瑞向更創(chuàng)新其中的典型代表,。
 一般情況下,,在新藥臨床試驗(yàn)申請(qǐng)(IND)前,,需要經(jīng)歷臨床前研究階段,此階段包括研究開(kāi)發(fā)和臨床前實(shí)驗(yàn)兩部分,,一般需要耗費(fèi)(4~7年),。如果是跟隨靶點(diǎn),由于不涉及靶點(diǎn)發(fā)現(xiàn),,時(shí)間會(huì)縮短,。以此推算,恒瑞最早可能在2015年左右就開(kāi)始了研究,。 而全球關(guān)于Aβ的研究需要追溯至上世紀(jì)90年代,,由于人類(lèi)對(duì)于阿爾茲海默病的發(fā)病原因和機(jī)理制并不完全清楚,藥物研發(fā)都基于各種假說(shuō)理論,,有學(xué)者就提出類(lèi)淀粉蛋白假說(shuō),,認(rèn)為可能是Aβ在大腦堆積導(dǎo)致阿爾茨海默病。也有一些研究數(shù)據(jù)體現(xiàn)了阿爾茨海默病嚴(yán)重程度與患者大腦中Aβ斑塊沉積有關(guān)性,。 但由于沒(méi)有 Aβ沉積與阿爾茲海默病患者認(rèn)知能力下降之間存在因果關(guān)系的確切證據(jù),,Aβ沉積假說(shuō)被認(rèn)為缺少作為藥物研發(fā)理論依據(jù)。在長(zhǎng)達(dá)近30的AD研發(fā)史中,,針對(duì) Aβ沉積的藥物無(wú)一成功,,Aducanumab的出現(xiàn)既讓人興奮,又備受爭(zhēng)議。 Aducanumab的研發(fā)歷程就像眾多藥企奮戰(zhàn)阿爾茨海默的一個(gè)縮影,,屢敗屢戰(zhàn),、前赴后繼。美國(guó)藥物生產(chǎn)與研發(fā)協(xié)會(huì)數(shù)據(jù)顯示,,全球累計(jì)在阿爾茲海默病上的研發(fā)投入超過(guò)6000億美元,,失敗的臨床藥物超過(guò)300種,,失敗率超過(guò)99%,,F(xiàn)DA已經(jīng)有17年未批準(zhǔn)針對(duì)阿爾茨海默氏病的藥物治療藥物。 2016年9月Aducanumab遇到令人沮喪的障礙,,彼時(shí)距離渤健啟動(dòng)兩項(xiàng)關(guān)于Aducanumab對(duì)AD的治療效果的III期臨床已經(jīng)一年,,通過(guò)患者腦部掃描分析結(jié)果表明該試驗(yàn)“不太可能達(dá)到主要終點(diǎn)”。 但渤健并沒(méi)有放棄,,選擇了繼續(xù)開(kāi)發(fā),。在太平洋彼岸,受益于新藥審評(píng)審批制度的改革推進(jìn),,國(guó)內(nèi)創(chuàng)新藥正在漸次萌芽,,特別是很早便覺(jué)醒要做創(chuàng)新轉(zhuǎn)型的恒瑞,前途未明的Aβ或許就是在這樣的背景下漂洋過(guò)海來(lái)到中國(guó),。 不過(guò),,Aducanumab還是沒(méi)能逃過(guò)前輩們的宿命。2019年3月,,渤健宣布終止Aducanumab的III期臨床試驗(yàn),。彼時(shí)恒瑞實(shí)驗(yàn)室對(duì)于Aβ的研究已經(jīng)是如火如荼,接近提交成果的時(shí)刻,,4個(gè)月后恒瑞在國(guó)家知識(shí)產(chǎn)權(quán)局提交的專(zhuān)利申請(qǐng)通過(guò),。 雖然宣布終止,但僅僅半年時(shí)間Aducanumab“啟思會(huì)上”,。2019年10月,,渤健表示通過(guò)增大患者數(shù)量并對(duì)數(shù)據(jù)重新進(jìn)行分析后發(fā)現(xiàn)高劑量(10mg/kg)的Aducanumab能夠顯著改善患者認(rèn)知能力, 因此宣布重新啟動(dòng)對(duì)Aducanumab的申請(qǐng)程序,,并計(jì)劃遞交BLA,。 雖然爭(zhēng)議仍在,F(xiàn)DA成為這場(chǎng)研發(fā)競(jìng)賽的“關(guān)鍵先生”,。 2020年8月,,F(xiàn)DA宣布已接受阿爾茨海默病在研藥物Aducanumab的BLA,并授予其優(yōu)先審查資格,,預(yù)計(jì)將于2021年3月7日做出審批決定,。美國(guó)媒體評(píng)價(jià)FDA此舉顯示其有意愿回應(yīng)市場(chǎng)對(duì)阿爾茲海默病的需求。 就在故事似乎要朝著“蓋棺定論”的方向發(fā)展之時(shí),變數(shù)再生,。 2020年11月,,F(xiàn)DA外部專(zhuān)家組成的咨詢委員會(huì)對(duì)Aducanumab說(shuō)了NO。盡管聽(tīng)證會(huì)上FDA不斷表示向外部專(zhuān)家組證明Aducanumab的有效性的,,但11人組成的專(zhuān)家組僅1人投票贊成,,8人反對(duì)其余專(zhuān)家則投出了棄權(quán)票。有專(zhuān)家表示理解阿爾茨海默癥的重要性和急迫性,,但如果因此就批準(zhǔn)一種無(wú)效藥物,,不僅對(duì)患者毫無(wú)益處,也對(duì)制藥行業(yè)發(fā)出錯(cuò)誤信號(hào),。 外界對(duì)Aducanumab的態(tài)度又變得消極起來(lái),。有華爾街分析師稱(chēng),在專(zhuān)家組如此表態(tài)下如果Aducanumab仍獲得批準(zhǔn),,那只能說(shuō)明“要么藥物無(wú)效分析無(wú)關(guān)緊要,,要么統(tǒng)計(jì)數(shù)據(jù)無(wú)關(guān)緊要,要么專(zhuān)家組投票結(jié)果無(wú)關(guān)緊要,。” 不過(guò),,第三次反轉(zhuǎn)來(lái)得更快。 2020年1月底,,渤健與衛(wèi)材聯(lián)合宣布,,F(xiàn)DA已將aducanumab的BLA審查期延長(zhǎng)了3個(gè)月。并且有消息傳出FDA將擴(kuò)大外部專(zhuān)家組的人數(shù),,以尋求“更多理解”,。市場(chǎng)也嗅到了FDA推進(jìn)aducanumab的“決心”,渤建股價(jià)一度攀升10%,,但在最終的博弈之下漲幅回落至5.62%,。 直到今天,Aducanumab能否獲批上市還未知,。 01 屢敗屢戰(zhàn),,MNC決戰(zhàn)AD 三十年中,向阿爾茨海默,、向失敗挑戰(zhàn)的遠(yuǎn)不止渤健,,還有前赴后繼的國(guó)際大藥企,盡管很多無(wú)功而返,,甚至耗費(fèi)了巨資,。 2012年,強(qiáng)生/輝瑞的單抗藥物Bapineuzumab臨床III期試驗(yàn)慘遭失敗,,福布斯的專(zhuān)欄文章評(píng)論道:“輝瑞和強(qiáng)生應(yīng)該進(jìn)行前瞻性試驗(yàn),,以驗(yàn)證β淀粉樣蛋白的清除對(duì)阿爾茨海默病治療的影響,,而不是進(jìn)行一系列可能耗資4億美元甚至更多的大規(guī)模試驗(yàn)。研發(fā)資金是寶貴的,,不應(yīng)浪費(fèi)在一廂情愿的想法上,。” 2014年,羅氏的AD藥物Gantenerumab也宣告失敗,,外媒在一項(xiàng)關(guān)于Gantenerumab和Solanezumab的臨床失敗報(bào)道中,,稱(chēng)一個(gè)藥物從idea到批準(zhǔn),大約需要12年,,而這項(xiàng)AD領(lǐng)域的研究可能超過(guò),,并且耗費(fèi)了約26億美元; 2016年,,扎根AD領(lǐng)域31年的禮來(lái)在該領(lǐng)域投入的30億美元,,隨著Solanezumab的III期臨床試驗(yàn)數(shù)據(jù)未達(dá)預(yù)期而付之東流,; 2017年,,默沙東宣布停止開(kāi)發(fā)減低β-淀粉樣蛋白的藥物Verubecestat; 2018年,,禮來(lái)/阿斯利康宣布終止治療阿爾茨海默病藥物lanabecestat全球多個(gè)III期臨床試驗(yàn),。 雖然阿爾茨海默病讓眾多國(guó)際大藥企無(wú)功而返,但也正因?yàn)槠潆y度大,、市場(chǎng)廣依舊吸引著大小藥企,、科研機(jī)構(gòu)布局。 根據(jù)國(guó)際阿爾茨海默病協(xié)會(huì)統(tǒng)計(jì),,全球已有超過(guò)5000萬(wàn)癡呆患者,,其中70%由阿爾茨海默病引起。隨著世界人口持續(xù)老年化,,該數(shù)字可能在2050年增至三倍,。Zion Market Research報(bào)告顯示,預(yù)計(jì)到2024年全球阿爾茨海默病藥物市場(chǎng)將達(dá)到56.6億美元,。這也讓中外生物制藥企業(yè)紛紛瞄準(zhǔn)阿爾茨海默病研發(fā)新藥,。 國(guó)家知識(shí)產(chǎn)權(quán)局官網(wǎng)顯示,國(guó)內(nèi)阿爾茨海默病相關(guān)專(zhuān)利超1800項(xiàng),。其中綠谷制藥在2019年前后申請(qǐng)了多項(xiàng)與阿爾茨海默病相關(guān)的專(zhuān)利,。作為“填補(bǔ)了過(guò)去17年阿爾茨海默癥治療領(lǐng)域無(wú)新藥上市的空白”的國(guó)產(chǎn)新藥,上海藥物所,、中國(guó)海洋大學(xué),、上海綠谷制藥聯(lián)合開(kāi)發(fā)的甘露特鈉(GV-971,商品名九期一®)自上市以來(lái)備受關(guān)注,。雖然這款藥此前備受爭(zhēng)議,,但并不影響其上市不久即賣(mài)斷貨,。今年2月,九期一®已在美國(guó)臨床研究中心完成Ⅲ期臨床試驗(yàn)首例患者給藥,,預(yù)計(jì)在2025年完成國(guó)際臨床試驗(yàn)的52周雙盲期研究計(jì)劃,,之后綠谷制藥將開(kāi)展歐美地區(qū)的新藥注冊(cè)上市工作。 除了已上市的九期一®外,,國(guó)內(nèi)外目前還未有真正意義上可減緩阿爾茨海默病病情的藥物上市,。由于阿爾茨海默病發(fā)病機(jī)理復(fù)雜,病因至今未明,,所以依舊是“世界難題”,。而在“正確答案”公布之前,不同的公司也根據(jù)不同的假說(shuō)用不同的方式試圖“解答”,。 2021年1月,,禮來(lái)宣布其靶向N3pG-β淀粉樣蛋白抗體藥物Donanemab治療早期阿爾茨海默病II期臨床研究(TRAILBLAZER-ALZ)達(dá)到主要終點(diǎn)。結(jié)果顯示,,Donanemab可顯著減緩早期阿爾茲海默病疾病進(jìn)展,,患者認(rèn)知和日常功能復(fù)合指標(biāo)(iADRS)下降較安慰劑減緩32%。 在2018年宣布停止阿爾茨海默病藥物研發(fā)之后,,2020年輝瑞又選擇與IBM合作,,共同打造人工智能(AI)模型以幫助人們預(yù)測(cè)阿爾茨海默病的發(fā)作。從藥物研發(fā)轉(zhuǎn)向預(yù)測(cè),、診斷,,也是一種新的“解題思路”。 與輝瑞“解題思路”相似的還有羅氏,。2020年,,羅氏公司旗下的基因泰克與其合作伙伴ACImmune公司聯(lián)合研發(fā)的靶向Tau淀粉樣蛋白抗體藥物Semorinemab的II期臨床試驗(yàn)未達(dá)到主要終點(diǎn)及兩個(gè)次要終點(diǎn)。研發(fā)受挫之后,,羅氏將目光轉(zhuǎn)向了量子計(jì)算機(jī)方向,。2021年,羅氏公司與英國(guó)劍橋量子計(jì)算公司(CambridgeQuantumComputing)合作,,計(jì)劃使用量子計(jì)算機(jī)軟件平臺(tái)來(lái)模擬量子層級(jí)的化學(xué)相互作用,,從而研發(fā)阿爾茨海默病的治療方法。 除了靶向β淀粉樣蛋白或Tau淀粉樣蛋白外,,還有一些機(jī)構(gòu)選擇從基因入手,,想從基因的角度來(lái)預(yù)防阿爾茨海默病。APOE4基因長(zhǎng)期以來(lái)被認(rèn)為是導(dǎo)致阿爾茨海默病的一個(gè)危險(xiǎn)因素,,所以包括麻省理工學(xué)院,、康奈爾大學(xué)威爾醫(yī)學(xué)院等著名院校在內(nèi)的研究機(jī)構(gòu)正試圖用CRISPR等基因編輯技術(shù)來(lái)改變APOE4基因,從而避免阿爾茨海默病的發(fā)生,。 解答一個(gè)“未解”但市場(chǎng)巨大的難題,,遠(yuǎn)比多答已有答案的題要艱難,、費(fèi)力得多,但這也是創(chuàng)新者們更想走的路,。 02 從仿制藥到創(chuàng)新者的冒險(xiǎn) 即便眾多MNC相繼在AD領(lǐng)域折戟,,恒瑞還是選擇了“往前再邁一步”,開(kāi)始嘗試探索更具創(chuàng)新性,、風(fēng)險(xiǎn)性的新領(lǐng)域了,。 復(fù)盤(pán)恒瑞近30年的發(fā)展歷史,其研發(fā)歷程分為三個(gè)階段:
一般情況下,,在新藥臨床試驗(yàn)申請(qǐng)(IND)前,,需要經(jīng)歷臨床前研究階段,此階段包括研究開(kāi)發(fā)和臨床前實(shí)驗(yàn)兩部分,,一般需要耗費(fèi)(4~7年),。如果是跟隨靶點(diǎn),由于不涉及靶點(diǎn)發(fā)現(xiàn),,時(shí)間會(huì)縮短,。以此推算,恒瑞最早可能在2015年左右就開(kāi)始了研究,。 而全球關(guān)于Aβ的研究需要追溯至上世紀(jì)90年代,,由于人類(lèi)對(duì)于阿爾茲海默病的發(fā)病原因和機(jī)理制并不完全清楚,藥物研發(fā)都基于各種假說(shuō)理論,,有學(xué)者就提出類(lèi)淀粉蛋白假說(shuō),,認(rèn)為可能是Aβ在大腦堆積導(dǎo)致阿爾茨海默病。也有一些研究數(shù)據(jù)體現(xiàn)了阿爾茨海默病嚴(yán)重程度與患者大腦中Aβ斑塊沉積有關(guān)性,。 但由于沒(méi)有 Aβ沉積與阿爾茲海默病患者認(rèn)知能力下降之間存在因果關(guān)系的確切證據(jù),,Aβ沉積假說(shuō)被認(rèn)為缺少作為藥物研發(fā)理論依據(jù)。在長(zhǎng)達(dá)近30的AD研發(fā)史中,,針對(duì) Aβ沉積的藥物無(wú)一成功,,Aducanumab的出現(xiàn)既讓人興奮,又備受爭(zhēng)議。 Aducanumab的研發(fā)歷程就像眾多藥企奮戰(zhàn)阿爾茨海默的一個(gè)縮影,,屢敗屢戰(zhàn),、前赴后繼。美國(guó)藥物生產(chǎn)與研發(fā)協(xié)會(huì)數(shù)據(jù)顯示,,全球累計(jì)在阿爾茲海默病上的研發(fā)投入超過(guò)6000億美元,,失敗的臨床藥物超過(guò)300種,,失敗率超過(guò)99%,,F(xiàn)DA已經(jīng)有17年未批準(zhǔn)針對(duì)阿爾茨海默氏病的藥物治療藥物。 2016年9月Aducanumab遇到令人沮喪的障礙,,彼時(shí)距離渤健啟動(dòng)兩項(xiàng)關(guān)于Aducanumab對(duì)AD的治療效果的III期臨床已經(jīng)一年,,通過(guò)患者腦部掃描分析結(jié)果表明該試驗(yàn)“不太可能達(dá)到主要終點(diǎn)”。 但渤健并沒(méi)有放棄,,選擇了繼續(xù)開(kāi)發(fā),。在太平洋彼岸,受益于新藥審評(píng)審批制度的改革推進(jìn),,國(guó)內(nèi)創(chuàng)新藥正在漸次萌芽,,特別是很早便覺(jué)醒要做創(chuàng)新轉(zhuǎn)型的恒瑞,前途未明的Aβ或許就是在這樣的背景下漂洋過(guò)海來(lái)到中國(guó),。 不過(guò),,Aducanumab還是沒(méi)能逃過(guò)前輩們的宿命。2019年3月,,渤健宣布終止Aducanumab的III期臨床試驗(yàn),。彼時(shí)恒瑞實(shí)驗(yàn)室對(duì)于Aβ的研究已經(jīng)是如火如荼,接近提交成果的時(shí)刻,,4個(gè)月后恒瑞在國(guó)家知識(shí)產(chǎn)權(quán)局提交的專(zhuān)利申請(qǐng)通過(guò),。 雖然宣布終止,但僅僅半年時(shí)間Aducanumab“啟思會(huì)上”,。2019年10月,,渤健表示通過(guò)增大患者數(shù)量并對(duì)數(shù)據(jù)重新進(jìn)行分析后發(fā)現(xiàn)高劑量(10mg/kg)的Aducanumab能夠顯著改善患者認(rèn)知能力, 因此宣布重新啟動(dòng)對(duì)Aducanumab的申請(qǐng)程序,,并計(jì)劃遞交BLA,。 雖然爭(zhēng)議仍在,F(xiàn)DA成為這場(chǎng)研發(fā)競(jìng)賽的“關(guān)鍵先生”,。 2020年8月,,F(xiàn)DA宣布已接受阿爾茨海默病在研藥物Aducanumab的BLA,并授予其優(yōu)先審查資格,,預(yù)計(jì)將于2021年3月7日做出審批決定,。美國(guó)媒體評(píng)價(jià)FDA此舉顯示其有意愿回應(yīng)市場(chǎng)對(duì)阿爾茲海默病的需求。 就在故事似乎要朝著“蓋棺定論”的方向發(fā)展之時(shí),變數(shù)再生,。 2020年11月,,F(xiàn)DA外部專(zhuān)家組成的咨詢委員會(huì)對(duì)Aducanumab說(shuō)了NO。盡管聽(tīng)證會(huì)上FDA不斷表示向外部專(zhuān)家組證明Aducanumab的有效性的,,但11人組成的專(zhuān)家組僅1人投票贊成,,8人反對(duì)其余專(zhuān)家則投出了棄權(quán)票。有專(zhuān)家表示理解阿爾茨海默癥的重要性和急迫性,,但如果因此就批準(zhǔn)一種無(wú)效藥物,,不僅對(duì)患者毫無(wú)益處,也對(duì)制藥行業(yè)發(fā)出錯(cuò)誤信號(hào),。 外界對(duì)Aducanumab的態(tài)度又變得消極起來(lái),。有華爾街分析師稱(chēng),在專(zhuān)家組如此表態(tài)下如果Aducanumab仍獲得批準(zhǔn),,那只能說(shuō)明“要么藥物無(wú)效分析無(wú)關(guān)緊要,,要么統(tǒng)計(jì)數(shù)據(jù)無(wú)關(guān)緊要,要么專(zhuān)家組投票結(jié)果無(wú)關(guān)緊要,。” 不過(guò),,第三次反轉(zhuǎn)來(lái)得更快。 2020年1月底,,渤健與衛(wèi)材聯(lián)合宣布,,F(xiàn)DA已將aducanumab的BLA審查期延長(zhǎng)了3個(gè)月。并且有消息傳出FDA將擴(kuò)大外部專(zhuān)家組的人數(shù),,以尋求“更多理解”,。市場(chǎng)也嗅到了FDA推進(jìn)aducanumab的“決心”,渤建股價(jià)一度攀升10%,,但在最終的博弈之下漲幅回落至5.62%,。 直到今天,Aducanumab能否獲批上市還未知,。 01 屢敗屢戰(zhàn),,MNC決戰(zhàn)AD 三十年中,向阿爾茨海默,、向失敗挑戰(zhàn)的遠(yuǎn)不止渤健,,還有前赴后繼的國(guó)際大藥企,盡管很多無(wú)功而返,,甚至耗費(fèi)了巨資,。 2012年,強(qiáng)生/輝瑞的單抗藥物Bapineuzumab臨床III期試驗(yàn)慘遭失敗,,福布斯的專(zhuān)欄文章評(píng)論道:“輝瑞和強(qiáng)生應(yīng)該進(jìn)行前瞻性試驗(yàn),,以驗(yàn)證β淀粉樣蛋白的清除對(duì)阿爾茨海默病治療的影響,,而不是進(jìn)行一系列可能耗資4億美元甚至更多的大規(guī)模試驗(yàn)。研發(fā)資金是寶貴的,,不應(yīng)浪費(fèi)在一廂情愿的想法上,。” 2014年,羅氏的AD藥物Gantenerumab也宣告失敗,,外媒在一項(xiàng)關(guān)于Gantenerumab和Solanezumab的臨床失敗報(bào)道中,,稱(chēng)一個(gè)藥物從idea到批準(zhǔn),大約需要12年,,而這項(xiàng)AD領(lǐng)域的研究可能超過(guò),,并且耗費(fèi)了約26億美元; 2016年,,扎根AD領(lǐng)域31年的禮來(lái)在該領(lǐng)域投入的30億美元,,隨著Solanezumab的III期臨床試驗(yàn)數(shù)據(jù)未達(dá)預(yù)期而付之東流,; 2017年,,默沙東宣布停止開(kāi)發(fā)減低β-淀粉樣蛋白的藥物Verubecestat; 2018年,,禮來(lái)/阿斯利康宣布終止治療阿爾茨海默病藥物lanabecestat全球多個(gè)III期臨床試驗(yàn),。 雖然阿爾茨海默病讓眾多國(guó)際大藥企無(wú)功而返,但也正因?yàn)槠潆y度大,、市場(chǎng)廣依舊吸引著大小藥企,、科研機(jī)構(gòu)布局。 根據(jù)國(guó)際阿爾茨海默病協(xié)會(huì)統(tǒng)計(jì),,全球已有超過(guò)5000萬(wàn)癡呆患者,,其中70%由阿爾茨海默病引起。隨著世界人口持續(xù)老年化,,該數(shù)字可能在2050年增至三倍,。Zion Market Research報(bào)告顯示,預(yù)計(jì)到2024年全球阿爾茨海默病藥物市場(chǎng)將達(dá)到56.6億美元,。這也讓中外生物制藥企業(yè)紛紛瞄準(zhǔn)阿爾茨海默病研發(fā)新藥,。 國(guó)家知識(shí)產(chǎn)權(quán)局官網(wǎng)顯示,國(guó)內(nèi)阿爾茨海默病相關(guān)專(zhuān)利超1800項(xiàng),。其中綠谷制藥在2019年前后申請(qǐng)了多項(xiàng)與阿爾茨海默病相關(guān)的專(zhuān)利,。作為“填補(bǔ)了過(guò)去17年阿爾茨海默癥治療領(lǐng)域無(wú)新藥上市的空白”的國(guó)產(chǎn)新藥,上海藥物所,、中國(guó)海洋大學(xué),、上海綠谷制藥聯(lián)合開(kāi)發(fā)的甘露特鈉(GV-971,商品名九期一®)自上市以來(lái)備受關(guān)注,。雖然這款藥此前備受爭(zhēng)議,,但并不影響其上市不久即賣(mài)斷貨,。今年2月,九期一®已在美國(guó)臨床研究中心完成Ⅲ期臨床試驗(yàn)首例患者給藥,,預(yù)計(jì)在2025年完成國(guó)際臨床試驗(yàn)的52周雙盲期研究計(jì)劃,,之后綠谷制藥將開(kāi)展歐美地區(qū)的新藥注冊(cè)上市工作。 除了已上市的九期一®外,,國(guó)內(nèi)外目前還未有真正意義上可減緩阿爾茨海默病病情的藥物上市,。由于阿爾茨海默病發(fā)病機(jī)理復(fù)雜,病因至今未明,,所以依舊是“世界難題”,。而在“正確答案”公布之前,不同的公司也根據(jù)不同的假說(shuō)用不同的方式試圖“解答”,。 2021年1月,,禮來(lái)宣布其靶向N3pG-β淀粉樣蛋白抗體藥物Donanemab治療早期阿爾茨海默病II期臨床研究(TRAILBLAZER-ALZ)達(dá)到主要終點(diǎn)。結(jié)果顯示,,Donanemab可顯著減緩早期阿爾茲海默病疾病進(jìn)展,,患者認(rèn)知和日常功能復(fù)合指標(biāo)(iADRS)下降較安慰劑減緩32%。 在2018年宣布停止阿爾茨海默病藥物研發(fā)之后,,2020年輝瑞又選擇與IBM合作,,共同打造人工智能(AI)模型以幫助人們預(yù)測(cè)阿爾茨海默病的發(fā)作。從藥物研發(fā)轉(zhuǎn)向預(yù)測(cè),、診斷,,也是一種新的“解題思路”。 與輝瑞“解題思路”相似的還有羅氏,。2020年,,羅氏公司旗下的基因泰克與其合作伙伴ACImmune公司聯(lián)合研發(fā)的靶向Tau淀粉樣蛋白抗體藥物Semorinemab的II期臨床試驗(yàn)未達(dá)到主要終點(diǎn)及兩個(gè)次要終點(diǎn)。研發(fā)受挫之后,,羅氏將目光轉(zhuǎn)向了量子計(jì)算機(jī)方向,。2021年,羅氏公司與英國(guó)劍橋量子計(jì)算公司(CambridgeQuantumComputing)合作,,計(jì)劃使用量子計(jì)算機(jī)軟件平臺(tái)來(lái)模擬量子層級(jí)的化學(xué)相互作用,,從而研發(fā)阿爾茨海默病的治療方法。 除了靶向β淀粉樣蛋白或Tau淀粉樣蛋白外,,還有一些機(jī)構(gòu)選擇從基因入手,,想從基因的角度來(lái)預(yù)防阿爾茨海默病。APOE4基因長(zhǎng)期以來(lái)被認(rèn)為是導(dǎo)致阿爾茨海默病的一個(gè)危險(xiǎn)因素,,所以包括麻省理工學(xué)院,、康奈爾大學(xué)威爾醫(yī)學(xué)院等著名院校在內(nèi)的研究機(jī)構(gòu)正試圖用CRISPR等基因編輯技術(shù)來(lái)改變APOE4基因,從而避免阿爾茨海默病的發(fā)生,。 解答一個(gè)“未解”但市場(chǎng)巨大的難題,,遠(yuǎn)比多答已有答案的題要艱難,、費(fèi)力得多,但這也是創(chuàng)新者們更想走的路,。 02 從仿制藥到創(chuàng)新者的冒險(xiǎn) 即便眾多MNC相繼在AD領(lǐng)域折戟,,恒瑞還是選擇了“往前再邁一步”,開(kāi)始嘗試探索更具創(chuàng)新性,、風(fēng)險(xiǎn)性的新領(lǐng)域了,。 復(fù)盤(pán)恒瑞近30年的發(fā)展歷史,其研發(fā)歷程分為三個(gè)階段:  一是仿制藥階段(2000年以前),,主要代表產(chǎn)品為異環(huán)磷酰胺,、多西他賽、伊立替康,、培門(mén)冬酶等,。 異環(huán)磷酰胺算是恒瑞最初的冒險(xiǎn),1992年孫飄揚(yáng)拿120萬(wàn)元,,去北京高校買(mǎi)新藥異環(huán)磷酰胺的專(zhuān)利,,這在當(dāng)時(shí)年利潤(rùn)不達(dá)100萬(wàn)的制藥廠來(lái)說(shuō)簡(jiǎn)直是“天文數(shù)字”。買(mǎi)回來(lái)的只是制造工藝,,臨床效果還未可知,。 1995年,,抗腫瘤藥異環(huán)磷酰胺經(jīng)批準(zhǔn)上市,,恒瑞第一次有了自己的“新藥”。據(jù)悉,,異環(huán)磷酰胺/巰乙磺酸鈉(I/M)于1988年12月首次獲美國(guó)FDA批準(zhǔn)上市,,并被列為最高等級(jí)1A級(jí)抗腫瘤藥。 恒瑞在異環(huán)磷酰胺嘗到了甜頭,,便開(kāi)始籌劃自主創(chuàng)新體系的構(gòu)建,。1992年恒瑞率先在連云港建起了2900平方的研究大樓,2000年投資2億元在上海建立新的研究中心,,2005年恒瑞挺進(jìn)海外,,以300萬(wàn)美元在美國(guó)舊金山籌建海外研究所。 由此恒瑞步入第二階段:仿創(chuàng)結(jié)合階段(2000年~2015年),。約2000年公司開(kāi)始著手創(chuàng)新藥的立項(xiàng)工作,,并于2003 年開(kāi)始第一個(gè)創(chuàng)新藥艾瑞昔布臨床申請(qǐng)。期間,,公司累計(jì)申報(bào)了26個(gè)創(chuàng)新藥的臨床,,艾瑞昔布與阿帕替尼分別于2011、2014 年獲批上市,,公司創(chuàng)新藥研發(fā)獲得階段性突破,,成為國(guó)內(nèi)唯一擁有2 個(gè)“新藥”的國(guó)產(chǎn)藥企,。 阿帕替尼作為恒瑞十年自主研發(fā)的抗腫瘤藥物,自上市以來(lái)銷(xiāo)量持續(xù)走高,,2015年銷(xiāo)售額約3億,,到了2019年銷(xiāo)售額直沖25.31億元,一舉成為恒瑞王牌產(chǎn)品,。加之新適應(yīng)癥獲批,,預(yù)計(jì)2020年阿帕替尼銷(xiāo)售額有望突破30億元。 在經(jīng)歷 2015-2016年臨床數(shù)據(jù)自查,、化學(xué)藥分類(lèi)改革的短期影響后,,恒瑞步入以創(chuàng)新為導(dǎo)向的第三階段。2018年-2020年,,恒瑞先后上市了馬來(lái)酸吡咯替尼片(商品名:艾瑞妮),、卡瑞利珠單抗、甲苯磺酸瑞瑪唑侖,、氟唑帕利膠囊4款重磅新藥,。在創(chuàng)新藥開(kāi)發(fā)上,恒瑞已基本形成每 2-3 年都有創(chuàng)新藥上市的良性發(fā)展態(tài)勢(shì),。 西南證券預(yù)計(jì),,2025年公司有望總計(jì)獲批 10 個(gè)左右的創(chuàng)新藥,創(chuàng)新藥收入有望達(dá)到公司營(yíng)收的 50%,,業(yè)績(jī)占比有望達(dá)到 70%,。個(gè)別創(chuàng)新藥有望在海外取得實(shí)質(zhì)性的突破,初步具備國(guó)際競(jìng)爭(zhēng)力,。 在一系列重大邁步之下,,恒瑞早已從仿制藥走在了Fast-Follow的前列,并且到了不僅僅滿足于Fast-Follow的階段,,其在AD領(lǐng)域的涉足僅僅是恒瑞向更創(chuàng)新其中的典型代表,。
一是仿制藥階段(2000年以前),,主要代表產(chǎn)品為異環(huán)磷酰胺,、多西他賽、伊立替康,、培門(mén)冬酶等,。 異環(huán)磷酰胺算是恒瑞最初的冒險(xiǎn),1992年孫飄揚(yáng)拿120萬(wàn)元,,去北京高校買(mǎi)新藥異環(huán)磷酰胺的專(zhuān)利,,這在當(dāng)時(shí)年利潤(rùn)不達(dá)100萬(wàn)的制藥廠來(lái)說(shuō)簡(jiǎn)直是“天文數(shù)字”。買(mǎi)回來(lái)的只是制造工藝,,臨床效果還未可知,。 1995年,,抗腫瘤藥異環(huán)磷酰胺經(jīng)批準(zhǔn)上市,,恒瑞第一次有了自己的“新藥”。據(jù)悉,,異環(huán)磷酰胺/巰乙磺酸鈉(I/M)于1988年12月首次獲美國(guó)FDA批準(zhǔn)上市,,并被列為最高等級(jí)1A級(jí)抗腫瘤藥。 恒瑞在異環(huán)磷酰胺嘗到了甜頭,,便開(kāi)始籌劃自主創(chuàng)新體系的構(gòu)建,。1992年恒瑞率先在連云港建起了2900平方的研究大樓,2000年投資2億元在上海建立新的研究中心,,2005年恒瑞挺進(jìn)海外,,以300萬(wàn)美元在美國(guó)舊金山籌建海外研究所。 由此恒瑞步入第二階段:仿創(chuàng)結(jié)合階段(2000年~2015年),。約2000年公司開(kāi)始著手創(chuàng)新藥的立項(xiàng)工作,,并于2003 年開(kāi)始第一個(gè)創(chuàng)新藥艾瑞昔布臨床申請(qǐng)。期間,,公司累計(jì)申報(bào)了26個(gè)創(chuàng)新藥的臨床,,艾瑞昔布與阿帕替尼分別于2011、2014 年獲批上市,,公司創(chuàng)新藥研發(fā)獲得階段性突破,,成為國(guó)內(nèi)唯一擁有2 個(gè)“新藥”的國(guó)產(chǎn)藥企,。 阿帕替尼作為恒瑞十年自主研發(fā)的抗腫瘤藥物,自上市以來(lái)銷(xiāo)量持續(xù)走高,,2015年銷(xiāo)售額約3億,,到了2019年銷(xiāo)售額直沖25.31億元,一舉成為恒瑞王牌產(chǎn)品,。加之新適應(yīng)癥獲批,,預(yù)計(jì)2020年阿帕替尼銷(xiāo)售額有望突破30億元。 在經(jīng)歷 2015-2016年臨床數(shù)據(jù)自查,、化學(xué)藥分類(lèi)改革的短期影響后,,恒瑞步入以創(chuàng)新為導(dǎo)向的第三階段。2018年-2020年,,恒瑞先后上市了馬來(lái)酸吡咯替尼片(商品名:艾瑞妮),、卡瑞利珠單抗、甲苯磺酸瑞瑪唑侖,、氟唑帕利膠囊4款重磅新藥,。在創(chuàng)新藥開(kāi)發(fā)上,恒瑞已基本形成每 2-3 年都有創(chuàng)新藥上市的良性發(fā)展態(tài)勢(shì),。 西南證券預(yù)計(jì),,2025年公司有望總計(jì)獲批 10 個(gè)左右的創(chuàng)新藥,創(chuàng)新藥收入有望達(dá)到公司營(yíng)收的 50%,,業(yè)績(jī)占比有望達(dá)到 70%,。個(gè)別創(chuàng)新藥有望在海外取得實(shí)質(zhì)性的突破,初步具備國(guó)際競(jìng)爭(zhēng)力,。 在一系列重大邁步之下,,恒瑞早已從仿制藥走在了Fast-Follow的前列,并且到了不僅僅滿足于Fast-Follow的階段,,其在AD領(lǐng)域的涉足僅僅是恒瑞向更創(chuàng)新其中的典型代表,。



