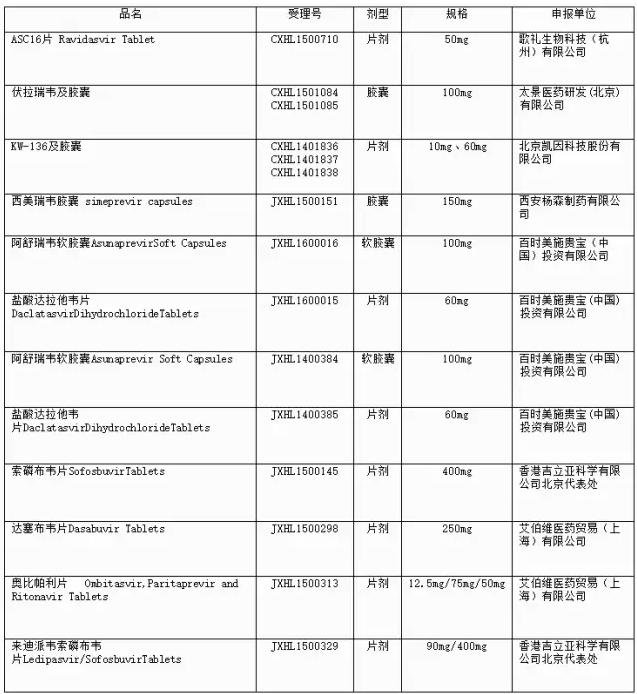
4月18日,,CDE官網(wǎng)公示了擬納入優(yōu)先審評(píng)程序HCV藥物注冊(cè)申請(qǐng),,公示期為5日。 根據(jù)CFDA《關(guān)于解決藥品注冊(cè)申請(qǐng)積壓實(shí)行優(yōu)先審評(píng)審批的意見(jiàn)》公告,,CDE于2016年4月12日組織專(zhuān)家,,按照《藥品審評(píng)中心優(yōu)先審評(píng)工作程序(試行)》對(duì)申請(qǐng)優(yōu)先審評(píng)的用于治療丙型肝炎病毒感染適應(yīng)癥的藥品注冊(cè)申請(qǐng)進(jìn)行了討論,下述藥物與我國(guó)現(xiàn)有治療丙型肝炎病毒藥品比較具有明顯的臨床優(yōu)勢(shì),,擬納入優(yōu)先審評(píng)程序: