新華社2月10日電 美國(guó)俄勒岡州立大學(xué)研究人員發(fā)現(xiàn),流感病毒在絕對(duì)濕度低的條件下最易存活和傳播,。研究人員說(shuō),,這能解釋為何流感多發(fā)于冬季,。
“當(dāng)絕對(duì)濕度低的時(shí)候,如在流感高發(fā)的1月和2月,,病毒看來(lái)存活時(shí)間更長(zhǎng),,更能有效傳播?!毖芯咳藛T在9日發(fā)表于《國(guó)家科學(xué)院學(xué)報(bào)》上的論文中說(shuō),。
絕對(duì)濕度指空氣中水蒸氣的實(shí)際含量,與溫度無(wú)關(guān),。相對(duì)濕度則隨溫度變化而變化,。之前的研究認(rèn)為,流感的傳播與相對(duì)濕度有關(guān),。
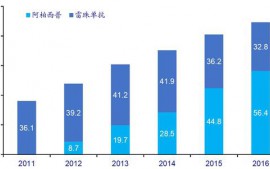
俄勒岡州立大學(xué)大氣學(xué)專(zhuān)家杰弗里·沙曼領(lǐng)導(dǎo)的研究團(tuán)隊(duì)重新審視過(guò)去研究結(jié)果后發(fā)現(xiàn),,只有12%的流感病毒傳播案例和36%的存活案例可以用相對(duì)濕度來(lái)解釋?zhuān)?0%的傳播案例和90%的存活案例可以用絕對(duì)濕度來(lái)解釋。
沙曼說(shuō):“在美國(guó)一些地區(qū),,一個(gè)典型夏日的水蒸氣含量可以達(dá)到冬天的4倍,,室內(nèi)室外都是這樣。因而,,流感往往暴發(fā)于絕對(duì)濕度低的冬季,,那時(shí)的條件有利于流感病毒存活和傳播?!?nbsp;
“當(dāng)絕對(duì)濕度低的時(shí)候,如在流感高發(fā)的1月和2月,,病毒看來(lái)存活時(shí)間更長(zhǎng),,更能有效傳播?!毖芯咳藛T在9日發(fā)表于《國(guó)家科學(xué)院學(xué)報(bào)》上的論文中說(shuō),。
絕對(duì)濕度指空氣中水蒸氣的實(shí)際含量,與溫度無(wú)關(guān),。相對(duì)濕度則隨溫度變化而變化,。之前的研究認(rèn)為,流感的傳播與相對(duì)濕度有關(guān),。
俄勒岡州立大學(xué)大氣學(xué)專(zhuān)家杰弗里·沙曼領(lǐng)導(dǎo)的研究團(tuán)隊(duì)重新審視過(guò)去研究結(jié)果后發(fā)現(xiàn),,只有12%的流感病毒傳播案例和36%的存活案例可以用相對(duì)濕度來(lái)解釋?zhuān)?0%的傳播案例和90%的存活案例可以用絕對(duì)濕度來(lái)解釋。
沙曼說(shuō):“在美國(guó)一些地區(qū),,一個(gè)典型夏日的水蒸氣含量可以達(dá)到冬天的4倍,,室內(nèi)室外都是這樣。因而,,流感往往暴發(fā)于絕對(duì)濕度低的冬季,,那時(shí)的條件有利于流感病毒存活和傳播?!?nbsp;