繼3月29日國(guó)家食藥監(jiān)總局公布《國(guó)家食品藥品監(jiān)督管理總局藥物臨床試驗(yàn)數(shù)據(jù)核查工作程序(暫行)》后,,昨日(3月30日),,國(guó)家食品藥品審核查驗(yàn)中心緊接著發(fā)布《藥物臨床試驗(yàn)數(shù)據(jù)現(xiàn)場(chǎng)核查計(jì)劃公告(第1號(hào))》,。 根據(jù)審核查驗(yàn)中心公告,國(guó)家食藥監(jiān)總局計(jì)劃對(duì)富馬酸貝達(dá)喹啉片等16個(gè)藥物臨床試驗(yàn)數(shù)據(jù)自查核查品種開(kāi)展現(xiàn)場(chǎng)核查,。公示期為 10 個(gè)工作日,,即2016年3月30日至4月13日。 以下為本次臨床試驗(yàn)數(shù)據(jù)現(xiàn)場(chǎng)核查品種目錄: 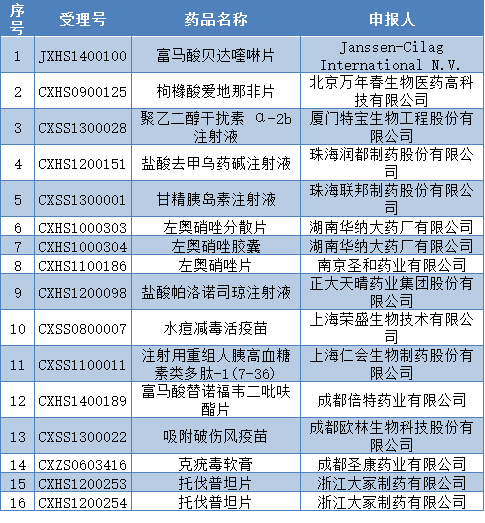 新一輪殘酷的數(shù)據(jù)核查已經(jīng)來(lái)臨,! 雖然被業(yè)內(nèi)人士戲稱(chēng)“史上最嚴(yán)數(shù)據(jù)核查”的“722慘案”已告一段路,,但是從官方文件來(lái)看,新一輪臨床數(shù)據(jù)核查的“號(hào)角聲”卻已經(jīng)嘹亮地吹響起來(lái),。 根據(jù)《國(guó)家食品藥品監(jiān)督管理總局藥物臨床試驗(yàn)數(shù)據(jù)核查工作程序(暫行)》規(guī)定,,藥品注冊(cè)申請(qǐng)人在公示后10個(gè)工作日內(nèi)未提出撤回申請(qǐng)的視為接受現(xiàn)場(chǎng)核查。網(wǎng)上公示期結(jié)束后,,對(duì)于未提出撤回申請(qǐng)的品種,,核查中心將通知藥品注冊(cè)申請(qǐng)人、臨床試驗(yàn)機(jī)構(gòu)及其所在地省級(jí)食品藥品監(jiān)管部門(mén)現(xiàn)場(chǎng)核查日期,,不再接受藥品注冊(cè)申請(qǐng)人的撤回申請(qǐng),。 檢查組應(yīng)按照《藥物臨床試驗(yàn)數(shù)據(jù)現(xiàn)場(chǎng)核查要點(diǎn)》內(nèi)容開(kāi)展現(xiàn)場(chǎng)核查;核查記錄應(yīng)具體,、準(zhǔn)確,、量化,對(duì)影響對(duì)藥物安全性,、有效性評(píng)價(jià)數(shù)據(jù)進(jìn)行真實(shí)性,、完整性判斷的,應(yīng)依法取證,。 國(guó)家食品藥品監(jiān)督管理總局作出審批決定后,,對(duì)現(xiàn)場(chǎng)核查發(fā)現(xiàn)問(wèn)題而不予批準(zhǔn)的藥品注冊(cè)申請(qǐng)相關(guān)情況予以公告。對(duì)涉嫌弄虛作假的立案調(diào)查,。 從國(guó)家局發(fā)布的核查工作程序上看,,被要求數(shù)據(jù)核查的品種只能在公示10天之內(nèi)撤回申請(qǐng),否則將接受?chē)?yán)苛的現(xiàn)場(chǎng)核查,。 據(jù)統(tǒng)計(jì),,在“722慘案”中,,撤回和不通過(guò)的品種超過(guò)80%,其中企業(yè)主動(dòng)撤回占了77%,。主動(dòng)撤回?cái)?shù)量如此之多,,與2015年第117號(hào)文件的以下要求有著密切關(guān)系:對(duì)核查中發(fā)現(xiàn)臨床試驗(yàn)數(shù)據(jù)真實(shí)性存在問(wèn)題的相關(guān)申請(qǐng)人,3年內(nèi)不受理其申請(qǐng),。藥物臨床試驗(yàn)機(jī)構(gòu)存在弄虛作假的,,吊銷(xiāo)藥物臨床試驗(yàn)機(jī)構(gòu)的資格;對(duì)臨床試驗(yàn)中存在違規(guī)行為的人員通報(bào)相關(guān)部門(mén)依法查處,。將弄虛作假的申請(qǐng)人,、臨床試驗(yàn)機(jī)構(gòu)、合同研究組織以及相關(guān)責(zé)任人員等列入黑名單,。 上文第一批“被盯上”的16個(gè)品種,,是會(huì)選擇冒著臨床試驗(yàn)數(shù)據(jù)真實(shí)性存在問(wèn)題的風(fēng)險(xiǎn),而硬著頭皮接受核查,?還是會(huì)像此前“722”一千多個(gè)品種那樣,,選擇割肉撤回? 臨床數(shù)據(jù)核查將成為常態(tài) 此前,,國(guó)家藥監(jiān)總局局長(zhǎng)畢井泉在座談會(huì)上表示,,將嚴(yán)懲故意造假,允許規(guī)范補(bǔ)正,。藥品注冊(cè)中請(qǐng)撤回是藥企的自愿行為,,總局并沒(méi)有對(duì)其今后的再次申報(bào)進(jìn)行差別對(duì)待。對(duì)不規(guī)范,、不完整的問(wèn)題,,允許企業(yè)重新自查,補(bǔ)充完善后重報(bào),。 吳湞副局長(zhǎng)也曾公開(kāi)表示,,針對(duì)省局核查“不細(xì)致”“核查質(zhì)量不高”等問(wèn)題,國(guó)家食藥監(jiān)總局將繼續(xù)組織核查,,若發(fā)現(xiàn)試驗(yàn)數(shù)據(jù)有問(wèn)題,,將同時(shí)追究未能有效履職的省局核查人員的責(zé)任,并公開(kāi)處理結(jié)果,。加強(qiáng)對(duì)臨床數(shù)據(jù)的核查要成為常態(tài),,凡是待審評(píng)上市的藥品必須逐一開(kāi)展臨床試驗(yàn)數(shù)據(jù)現(xiàn)場(chǎng)核查。 今年的第一批現(xiàn)場(chǎng)核查已經(jīng)來(lái)臨,,按國(guó)家局的要求,,臨床數(shù)據(jù)核查成為常態(tài),那么第二批,、第三批……第N批也將陸續(xù)到來(lái),。各大藥企們,,時(shí)刻準(zhǔn)備著吧!
新一輪殘酷的數(shù)據(jù)核查已經(jīng)來(lái)臨,! 雖然被業(yè)內(nèi)人士戲稱(chēng)“史上最嚴(yán)數(shù)據(jù)核查”的“722慘案”已告一段路,,但是從官方文件來(lái)看,新一輪臨床數(shù)據(jù)核查的“號(hào)角聲”卻已經(jīng)嘹亮地吹響起來(lái),。 根據(jù)《國(guó)家食品藥品監(jiān)督管理總局藥物臨床試驗(yàn)數(shù)據(jù)核查工作程序(暫行)》規(guī)定,,藥品注冊(cè)申請(qǐng)人在公示后10個(gè)工作日內(nèi)未提出撤回申請(qǐng)的視為接受現(xiàn)場(chǎng)核查。網(wǎng)上公示期結(jié)束后,,對(duì)于未提出撤回申請(qǐng)的品種,,核查中心將通知藥品注冊(cè)申請(qǐng)人、臨床試驗(yàn)機(jī)構(gòu)及其所在地省級(jí)食品藥品監(jiān)管部門(mén)現(xiàn)場(chǎng)核查日期,,不再接受藥品注冊(cè)申請(qǐng)人的撤回申請(qǐng),。 檢查組應(yīng)按照《藥物臨床試驗(yàn)數(shù)據(jù)現(xiàn)場(chǎng)核查要點(diǎn)》內(nèi)容開(kāi)展現(xiàn)場(chǎng)核查;核查記錄應(yīng)具體,、準(zhǔn)確,、量化,對(duì)影響對(duì)藥物安全性,、有效性評(píng)價(jià)數(shù)據(jù)進(jìn)行真實(shí)性,、完整性判斷的,應(yīng)依法取證,。 國(guó)家食品藥品監(jiān)督管理總局作出審批決定后,,對(duì)現(xiàn)場(chǎng)核查發(fā)現(xiàn)問(wèn)題而不予批準(zhǔn)的藥品注冊(cè)申請(qǐng)相關(guān)情況予以公告。對(duì)涉嫌弄虛作假的立案調(diào)查,。 從國(guó)家局發(fā)布的核查工作程序上看,,被要求數(shù)據(jù)核查的品種只能在公示10天之內(nèi)撤回申請(qǐng),否則將接受?chē)?yán)苛的現(xiàn)場(chǎng)核查,。 據(jù)統(tǒng)計(jì),,在“722慘案”中,,撤回和不通過(guò)的品種超過(guò)80%,其中企業(yè)主動(dòng)撤回占了77%,。主動(dòng)撤回?cái)?shù)量如此之多,,與2015年第117號(hào)文件的以下要求有著密切關(guān)系:對(duì)核查中發(fā)現(xiàn)臨床試驗(yàn)數(shù)據(jù)真實(shí)性存在問(wèn)題的相關(guān)申請(qǐng)人,3年內(nèi)不受理其申請(qǐng),。藥物臨床試驗(yàn)機(jī)構(gòu)存在弄虛作假的,,吊銷(xiāo)藥物臨床試驗(yàn)機(jī)構(gòu)的資格;對(duì)臨床試驗(yàn)中存在違規(guī)行為的人員通報(bào)相關(guān)部門(mén)依法查處,。將弄虛作假的申請(qǐng)人,、臨床試驗(yàn)機(jī)構(gòu)、合同研究組織以及相關(guān)責(zé)任人員等列入黑名單,。 上文第一批“被盯上”的16個(gè)品種,,是會(huì)選擇冒著臨床試驗(yàn)數(shù)據(jù)真實(shí)性存在問(wèn)題的風(fēng)險(xiǎn),而硬著頭皮接受核查,?還是會(huì)像此前“722”一千多個(gè)品種那樣,,選擇割肉撤回? 臨床數(shù)據(jù)核查將成為常態(tài) 此前,,國(guó)家藥監(jiān)總局局長(zhǎng)畢井泉在座談會(huì)上表示,,將嚴(yán)懲故意造假,允許規(guī)范補(bǔ)正,。藥品注冊(cè)中請(qǐng)撤回是藥企的自愿行為,,總局并沒(méi)有對(duì)其今后的再次申報(bào)進(jìn)行差別對(duì)待。對(duì)不規(guī)范,、不完整的問(wèn)題,,允許企業(yè)重新自查,補(bǔ)充完善后重報(bào),。 吳湞副局長(zhǎng)也曾公開(kāi)表示,,針對(duì)省局核查“不細(xì)致”“核查質(zhì)量不高”等問(wèn)題,國(guó)家食藥監(jiān)總局將繼續(xù)組織核查,,若發(fā)現(xiàn)試驗(yàn)數(shù)據(jù)有問(wèn)題,,將同時(shí)追究未能有效履職的省局核查人員的責(zé)任,并公開(kāi)處理結(jié)果,。加強(qiáng)對(duì)臨床數(shù)據(jù)的核查要成為常態(tài),,凡是待審評(píng)上市的藥品必須逐一開(kāi)展臨床試驗(yàn)數(shù)據(jù)現(xiàn)場(chǎng)核查。 今年的第一批現(xiàn)場(chǎng)核查已經(jīng)來(lái)臨,,按國(guó)家局的要求,,臨床數(shù)據(jù)核查成為常態(tài),那么第二批,、第三批……第N批也將陸續(xù)到來(lái),。各大藥企們,,時(shí)刻準(zhǔn)備著吧!
 新一輪殘酷的數(shù)據(jù)核查已經(jīng)來(lái)臨,! 雖然被業(yè)內(nèi)人士戲稱(chēng)“史上最嚴(yán)數(shù)據(jù)核查”的“722慘案”已告一段路,,但是從官方文件來(lái)看,新一輪臨床數(shù)據(jù)核查的“號(hào)角聲”卻已經(jīng)嘹亮地吹響起來(lái),。 根據(jù)《國(guó)家食品藥品監(jiān)督管理總局藥物臨床試驗(yàn)數(shù)據(jù)核查工作程序(暫行)》規(guī)定,,藥品注冊(cè)申請(qǐng)人在公示后10個(gè)工作日內(nèi)未提出撤回申請(qǐng)的視為接受現(xiàn)場(chǎng)核查。網(wǎng)上公示期結(jié)束后,,對(duì)于未提出撤回申請(qǐng)的品種,,核查中心將通知藥品注冊(cè)申請(qǐng)人、臨床試驗(yàn)機(jī)構(gòu)及其所在地省級(jí)食品藥品監(jiān)管部門(mén)現(xiàn)場(chǎng)核查日期,,不再接受藥品注冊(cè)申請(qǐng)人的撤回申請(qǐng),。 檢查組應(yīng)按照《藥物臨床試驗(yàn)數(shù)據(jù)現(xiàn)場(chǎng)核查要點(diǎn)》內(nèi)容開(kāi)展現(xiàn)場(chǎng)核查;核查記錄應(yīng)具體,、準(zhǔn)確,、量化,對(duì)影響對(duì)藥物安全性,、有效性評(píng)價(jià)數(shù)據(jù)進(jìn)行真實(shí)性,、完整性判斷的,應(yīng)依法取證,。 國(guó)家食品藥品監(jiān)督管理總局作出審批決定后,,對(duì)現(xiàn)場(chǎng)核查發(fā)現(xiàn)問(wèn)題而不予批準(zhǔn)的藥品注冊(cè)申請(qǐng)相關(guān)情況予以公告。對(duì)涉嫌弄虛作假的立案調(diào)查,。 從國(guó)家局發(fā)布的核查工作程序上看,,被要求數(shù)據(jù)核查的品種只能在公示10天之內(nèi)撤回申請(qǐng),否則將接受?chē)?yán)苛的現(xiàn)場(chǎng)核查,。 據(jù)統(tǒng)計(jì),,在“722慘案”中,,撤回和不通過(guò)的品種超過(guò)80%,其中企業(yè)主動(dòng)撤回占了77%,。主動(dòng)撤回?cái)?shù)量如此之多,,與2015年第117號(hào)文件的以下要求有著密切關(guān)系:對(duì)核查中發(fā)現(xiàn)臨床試驗(yàn)數(shù)據(jù)真實(shí)性存在問(wèn)題的相關(guān)申請(qǐng)人,3年內(nèi)不受理其申請(qǐng),。藥物臨床試驗(yàn)機(jī)構(gòu)存在弄虛作假的,,吊銷(xiāo)藥物臨床試驗(yàn)機(jī)構(gòu)的資格;對(duì)臨床試驗(yàn)中存在違規(guī)行為的人員通報(bào)相關(guān)部門(mén)依法查處,。將弄虛作假的申請(qǐng)人,、臨床試驗(yàn)機(jī)構(gòu)、合同研究組織以及相關(guān)責(zé)任人員等列入黑名單,。 上文第一批“被盯上”的16個(gè)品種,,是會(huì)選擇冒著臨床試驗(yàn)數(shù)據(jù)真實(shí)性存在問(wèn)題的風(fēng)險(xiǎn),而硬著頭皮接受核查,?還是會(huì)像此前“722”一千多個(gè)品種那樣,,選擇割肉撤回? 臨床數(shù)據(jù)核查將成為常態(tài) 此前,,國(guó)家藥監(jiān)總局局長(zhǎng)畢井泉在座談會(huì)上表示,,將嚴(yán)懲故意造假,允許規(guī)范補(bǔ)正,。藥品注冊(cè)中請(qǐng)撤回是藥企的自愿行為,,總局并沒(méi)有對(duì)其今后的再次申報(bào)進(jìn)行差別對(duì)待。對(duì)不規(guī)范,、不完整的問(wèn)題,,允許企業(yè)重新自查,補(bǔ)充完善后重報(bào),。 吳湞副局長(zhǎng)也曾公開(kāi)表示,,針對(duì)省局核查“不細(xì)致”“核查質(zhì)量不高”等問(wèn)題,國(guó)家食藥監(jiān)總局將繼續(xù)組織核查,,若發(fā)現(xiàn)試驗(yàn)數(shù)據(jù)有問(wèn)題,,將同時(shí)追究未能有效履職的省局核查人員的責(zé)任,并公開(kāi)處理結(jié)果,。加強(qiáng)對(duì)臨床數(shù)據(jù)的核查要成為常態(tài),,凡是待審評(píng)上市的藥品必須逐一開(kāi)展臨床試驗(yàn)數(shù)據(jù)現(xiàn)場(chǎng)核查。 今年的第一批現(xiàn)場(chǎng)核查已經(jīng)來(lái)臨,,按國(guó)家局的要求,,臨床數(shù)據(jù)核查成為常態(tài),那么第二批,、第三批……第N批也將陸續(xù)到來(lái),。各大藥企們,,時(shí)刻準(zhǔn)備著吧!
新一輪殘酷的數(shù)據(jù)核查已經(jīng)來(lái)臨,! 雖然被業(yè)內(nèi)人士戲稱(chēng)“史上最嚴(yán)數(shù)據(jù)核查”的“722慘案”已告一段路,,但是從官方文件來(lái)看,新一輪臨床數(shù)據(jù)核查的“號(hào)角聲”卻已經(jīng)嘹亮地吹響起來(lái),。 根據(jù)《國(guó)家食品藥品監(jiān)督管理總局藥物臨床試驗(yàn)數(shù)據(jù)核查工作程序(暫行)》規(guī)定,,藥品注冊(cè)申請(qǐng)人在公示后10個(gè)工作日內(nèi)未提出撤回申請(qǐng)的視為接受現(xiàn)場(chǎng)核查。網(wǎng)上公示期結(jié)束后,,對(duì)于未提出撤回申請(qǐng)的品種,,核查中心將通知藥品注冊(cè)申請(qǐng)人、臨床試驗(yàn)機(jī)構(gòu)及其所在地省級(jí)食品藥品監(jiān)管部門(mén)現(xiàn)場(chǎng)核查日期,,不再接受藥品注冊(cè)申請(qǐng)人的撤回申請(qǐng),。 檢查組應(yīng)按照《藥物臨床試驗(yàn)數(shù)據(jù)現(xiàn)場(chǎng)核查要點(diǎn)》內(nèi)容開(kāi)展現(xiàn)場(chǎng)核查;核查記錄應(yīng)具體,、準(zhǔn)確,、量化,對(duì)影響對(duì)藥物安全性,、有效性評(píng)價(jià)數(shù)據(jù)進(jìn)行真實(shí)性,、完整性判斷的,應(yīng)依法取證,。 國(guó)家食品藥品監(jiān)督管理總局作出審批決定后,,對(duì)現(xiàn)場(chǎng)核查發(fā)現(xiàn)問(wèn)題而不予批準(zhǔn)的藥品注冊(cè)申請(qǐng)相關(guān)情況予以公告。對(duì)涉嫌弄虛作假的立案調(diào)查,。 從國(guó)家局發(fā)布的核查工作程序上看,,被要求數(shù)據(jù)核查的品種只能在公示10天之內(nèi)撤回申請(qǐng),否則將接受?chē)?yán)苛的現(xiàn)場(chǎng)核查,。 據(jù)統(tǒng)計(jì),,在“722慘案”中,,撤回和不通過(guò)的品種超過(guò)80%,其中企業(yè)主動(dòng)撤回占了77%,。主動(dòng)撤回?cái)?shù)量如此之多,,與2015年第117號(hào)文件的以下要求有著密切關(guān)系:對(duì)核查中發(fā)現(xiàn)臨床試驗(yàn)數(shù)據(jù)真實(shí)性存在問(wèn)題的相關(guān)申請(qǐng)人,3年內(nèi)不受理其申請(qǐng),。藥物臨床試驗(yàn)機(jī)構(gòu)存在弄虛作假的,,吊銷(xiāo)藥物臨床試驗(yàn)機(jī)構(gòu)的資格;對(duì)臨床試驗(yàn)中存在違規(guī)行為的人員通報(bào)相關(guān)部門(mén)依法查處,。將弄虛作假的申請(qǐng)人,、臨床試驗(yàn)機(jī)構(gòu)、合同研究組織以及相關(guān)責(zé)任人員等列入黑名單,。 上文第一批“被盯上”的16個(gè)品種,,是會(huì)選擇冒著臨床試驗(yàn)數(shù)據(jù)真實(shí)性存在問(wèn)題的風(fēng)險(xiǎn),而硬著頭皮接受核查,?還是會(huì)像此前“722”一千多個(gè)品種那樣,,選擇割肉撤回? 臨床數(shù)據(jù)核查將成為常態(tài) 此前,,國(guó)家藥監(jiān)總局局長(zhǎng)畢井泉在座談會(huì)上表示,,將嚴(yán)懲故意造假,允許規(guī)范補(bǔ)正,。藥品注冊(cè)中請(qǐng)撤回是藥企的自愿行為,,總局并沒(méi)有對(duì)其今后的再次申報(bào)進(jìn)行差別對(duì)待。對(duì)不規(guī)范,、不完整的問(wèn)題,,允許企業(yè)重新自查,補(bǔ)充完善后重報(bào),。 吳湞副局長(zhǎng)也曾公開(kāi)表示,,針對(duì)省局核查“不細(xì)致”“核查質(zhì)量不高”等問(wèn)題,國(guó)家食藥監(jiān)總局將繼續(xù)組織核查,,若發(fā)現(xiàn)試驗(yàn)數(shù)據(jù)有問(wèn)題,,將同時(shí)追究未能有效履職的省局核查人員的責(zé)任,并公開(kāi)處理結(jié)果,。加強(qiáng)對(duì)臨床數(shù)據(jù)的核查要成為常態(tài),,凡是待審評(píng)上市的藥品必須逐一開(kāi)展臨床試驗(yàn)數(shù)據(jù)現(xiàn)場(chǎng)核查。 今年的第一批現(xiàn)場(chǎng)核查已經(jīng)來(lái)臨,,按國(guó)家局的要求,,臨床數(shù)據(jù)核查成為常態(tài),那么第二批,、第三批……第N批也將陸續(xù)到來(lái),。各大藥企們,,時(shí)刻準(zhǔn)備著吧! 






