臨床需求 帶動兒童藥升量的兩大引擎 兒科看病有多難 根據(jù)國家衛(wèi)生計生委數(shù)據(jù),我國目前有2.3億14歲以下的兒童,,占全國總?cè)丝诘?6.6%,,隨著全面二胎政策落地,預(yù)計新生兒數(shù)量將在未來幾年呈遞增態(tài)勢,,每年將新增新生兒約300萬~400萬人,。 2015年,兒科門急診人數(shù)達(dá)5.4億人次,,占全部門急診人數(shù)的9.6%,。兒童醫(yī)療服務(wù)剛需強勁,但我國兒科服務(wù)的資源整體總量不足且配置結(jié)構(gòu)不盡合理,。兒童???a href="http://hnhlg.com/sell/list-153.html" target="_blank">醫(yī)院僅有99家(其中公立醫(yī)院69家,,私立醫(yī)院30家),僅占全國醫(yī)療機構(gòu)的0.38%,,且主要集中在東南大中城市,,資源分布嚴(yán)重不均。兒科床位25.8萬張,,僅占全國醫(yī)院總床位數(shù)的6.4%,,兒童醫(yī)院病床使用率一直處于高位,2014年達(dá)到103.8%,。 兒童“看病難”主要矛盾發(fā)生在季節(jié)性兒童疾病的高發(fā)期,,兒童集中就醫(yī),大城市兒科??漆t(yī)院都出現(xiàn)了非常緊張的局面,。最近各城市禁止加號后,更是加大了兒童就醫(yī)的難度,,去大醫(yī)院掛不上號,,去社區(qū)醫(yī)院全科醫(yī)生又自謙經(jīng)驗不足請患兒轉(zhuǎn)醫(yī)大醫(yī)院。分級醫(yī)療分流患者的目標(biāo)和流程達(dá)成了,,然而對于患者而言,,“看病難”的問題不但沒有解決,反而是難度升級,。 “十三五”擴容力度 短期兒童“看病難”矛盾難以調(diào)和,,那么國家的長期投入又是如何呢? “十三五”時期,,國家將增加兒科醫(yī)療資源的供給,,加大投資力度,力爭實現(xiàn)每個省區(qū)市都能有一所兒童醫(yī)院,,常住人口超過300萬的地級市設(shè)置一所兒童醫(yī)院,,二級以上的綜合醫(yī)院都要設(shè)置兒科,縣級的公立醫(yī)院和兒科需求量比較大的城市的公立醫(yī)院也要設(shè)置兒科病房,。每個省市縣都要設(shè)置一所政府舉辦的標(biāo)準(zhǔn)化婦幼保健機構(gòu),,將兒童家庭作為基層全科醫(yī)生、家庭醫(yī)生重點簽約的對象,,引導(dǎo)社會力量來舉辦兒童的醫(yī)療機構(gòu),。這意味著,2020年國內(nèi)的兒童“看病難”將有望得到解決,,兒科醫(yī)院數(shù)量的擴容將帶動兒童藥市場升量,。 藥品格局 兒科藥究竟“缺”什么? 這邊廂,,兒科藥品“成人化”成為兒科藥品缺乏的重要證據(jù),。有數(shù)據(jù)指出,,國內(nèi)市場90%的兒童使用的是成人藥物的減量版。 說明書最常見的字眼就是“小兒酌情減半”“遵醫(yī)囑”或“慎用”等字樣,,對于家長實際使用而言,,無法準(zhǔn)確推斷藥品用量,藥品服用的依從性和便利性非常差,。針劑同樣有最小劑量仍超過兒童所能注射的最高劑量的問題,。 除了藥品說明書用法用量不完善,藥代動力學(xué)未標(biāo)準(zhǔn)至兒童,、未經(jīng)臨床確定的供兒童使用安全有效的信息缺乏,,也是我國兒科藥品顯著的問題。這些問題并不是我國獨有的,,而是全世界的共性問題,。 兒科臨床試驗難做是現(xiàn)有研發(fā)的主要難點之一。將兒童納入臨床試驗的倫理因素,、受試兒童患者不足的人口因素,、短缺的兒科醫(yī)生研究者因素、有待提高的研究技術(shù)因素,、制藥企業(yè)高風(fēng)險低回報的經(jīng)濟效應(yīng)因素等,,都是兒科臨床試驗難以開展的影響因素。兒科臨床研究不足進一步增加了針對兒童的適應(yīng)癥獲批的難度,,導(dǎo)致兒科藥品的缺藥無法避免,。 那邊廂,目前已上市的兒科藥品的競爭激烈,,普遍廠家的銷售額業(yè)績平平,銷售額排前列的產(chǎn)品的市場占有率也較低,,顯示出兒科藥品的市場競爭非常激烈,。這主要根源是已上市的兒科用藥產(chǎn)品同質(zhì)化較嚴(yán)重,化藥基本是多家生產(chǎn)的,,中成藥雖然產(chǎn)品名為獨家,,組方略有不同,但適應(yīng)癥趨于雷同,。 我國兒童藥缺的是未在我國上市但在歐,、美、日上市的臨床必需的治療用藥,,以及從安全性和服用便利性考慮的日常常見疾病成人用藥延伸至兒童使用的小規(guī)格,;最不缺的則是同質(zhì)化較嚴(yán)重、生產(chǎn)廠家數(shù)較多的化藥普藥和適應(yīng)癥雷同的中成藥,。 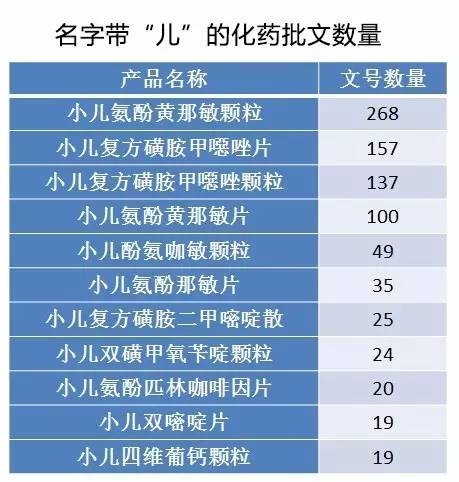 頭腦風(fēng)暴 政策,、立項,、營銷的對策 1、立項考量:關(guān)注兒童疾病譜變化 兒科藥品的立項首先要關(guān)注臨床需求,。隨著我國經(jīng)濟水平的發(fā)展,,兒童健康需求亦有所改變。我國目前學(xué)齡前兒童體格發(fā)育狀況良好,,低體質(zhì)量,、生長遲緩、消瘦發(fā)生率較低,,但超重及肥胖的發(fā)生率增高,,兒科藥品的開發(fā)可以關(guān)注由于偏食所導(dǎo)致的營養(yǎng)不良,超重和肥胖以及相關(guān)并發(fā)癥等疾病,。 由于環(huán)境污染等因素,,兒童腫瘤患病率增加。良性軟組織腫瘤是兒童最常見的良性腫瘤,。惡性腫瘤中,,以淋巴、造血系統(tǒng)和有關(guān)組織腫瘤占首位,,其次為起源于胚胎組織的神經(jīng)母細(xì)胞瘤,。兒童動態(tài)未定和未知腫瘤以顱內(nèi)及椎管內(nèi)腫瘤占首位。腫瘤是國家關(guān)注的重點領(lǐng)域,,研發(fā)兒童腫瘤有望獲得加快審批等政策扶持,。 此外,雙重特殊兒童的數(shù)量增加值得關(guān)注,。雙重特殊兒童,,是指那些在某些領(lǐng)域擁有超常能力,但同時又伴有某些障礙的兒童,。這些兒童智力或能力超過正常人但身心有缺陷,,如聽力障礙、視覺障礙,、肢體殘疾,、語言障礙、情緒情感異常等,。目前雙重特殊兒童研究主要集中在特殊學(xué)習(xí)障礙兒童,、注意缺陷多動障礙兒童和自閉癥兒童這三大類別上,藥物治療對以上類別兒童而言效果一般,,仍有進一步深挖的潛力,。 2、政策扶持:借鑒美國“他山之石” 美國通過實施《兒童最佳藥品法案》與《兒科研究公平法案》來激勵并強制兒科專用藥的臨床研究,。按照FDA批準(zhǔn)的書面請求完成兒科研究的專利藥品,,將被授予在其原有的專利期之后增加長達(dá)6個月的兒科獨占期的獎勵,。無法獲得兒科獨占期的非專利藥品,則依據(jù)規(guī)定給予一定數(shù)額的專項研究撥款,。此外,,新藥申請或補充申請時,除非經(jīng)FDA同意準(zhǔn)予延期或免除兒科評價,,否則都必須進行兒科評價,。 針對兒科專用藥研發(fā)困難、企業(yè)在某些領(lǐng)域研發(fā)積極性不高的狀況,,美國政府采取了與制藥企業(yè)合作研究開發(fā)兒科藥品臨床試驗的方式,,促進藥品的研發(fā)和審批程序,從而實現(xiàn)成果快速轉(zhuǎn)化,。 鑒于此,,我國政府也可主動探索與制藥企業(yè)在基礎(chǔ)研究和非專利藥兒科臨床試驗的合作,選擇兒科需求量較大但尚無兒科專用藥的非專利品種進行研究,。此外,,政府還可通過各類基金與企業(yè)簽訂合作開發(fā)協(xié)議,為特定兒科藥物的臨床研究提供技術(shù),、設(shè)施和資金支持,,合作中獲得的專利證書屬于政府和企業(yè)共同所有,允許企業(yè)保留專利,,并且企業(yè)可以利用該權(quán)利深入開發(fā)產(chǎn)品并推動產(chǎn)品上市,,加速研究成果的審批和商業(yè)化。 3,、營銷突圍:臨床證據(jù)挖掘和OTC布局 我國目前上市的兒科藥品主要是生產(chǎn)廠家數(shù)較多的化藥普藥和適應(yīng)癥基本相同的中成藥,。生產(chǎn)廠家數(shù)較多的兒科化藥普藥,通常上市時間都非常久,,臨床處方醫(yī)生對此類藥品都非常熟悉,,價格也由于多家競標(biāo)早已成為低價藥水平。這類藥品的生產(chǎn)廠家基本沒有推廣費用,,日常銷售主要靠自然銷售,也基本沒有突圍的需求,。 有推廣空間且有突圍需求的,,往往是價格維護較好且獨家的中成藥。此類藥品雖然有婦兒藥掛網(wǎng)采購的利好,,但在醫(yī)院覆蓋中往往受到醫(yī)院限制輔助用藥和中成藥等政策阻擊,,難以在醫(yī)院層面上有所作為。 進入臨床途徑或指南,,將是中成藥的主要突破點,,而這個突破點現(xiàn)在越來越講究臨床證據(jù),。因此,兒科中成藥營銷突圍首先就要做中藥再評價試驗,,挖掘臨床證據(jù),,證實其安全性和臨床使用的必要性,才能在醫(yī)院目錄中博得一席之地,。 此外,,生產(chǎn)廠家不妨盡早布局OTC終端,因為醫(yī)療資源緊缺將帶動部分家長為便利而在OTC購藥,。 不過,,生產(chǎn)廠家在進入OTC終端前,須根據(jù)產(chǎn)品特點和企業(yè)資源對產(chǎn)品進行更符合OTC銷售的品牌定位,,對產(chǎn)品進行二次開發(fā),,如產(chǎn)品的外觀設(shè)計、口感口味等,,這將有助于產(chǎn)品在OTC終端突圍,。生產(chǎn)廠家也可以考慮通過貼牌、并購等方式擴充自己的產(chǎn)品線,,通過系列組合方式整合各種差異化的產(chǎn)品,,推出整體品牌,發(fā)揮品牌的協(xié)同作用,,提升品牌的知曉度,。
頭腦風(fēng)暴 政策,、立項,、營銷的對策 1、立項考量:關(guān)注兒童疾病譜變化 兒科藥品的立項首先要關(guān)注臨床需求,。隨著我國經(jīng)濟水平的發(fā)展,,兒童健康需求亦有所改變。我國目前學(xué)齡前兒童體格發(fā)育狀況良好,,低體質(zhì)量,、生長遲緩、消瘦發(fā)生率較低,,但超重及肥胖的發(fā)生率增高,,兒科藥品的開發(fā)可以關(guān)注由于偏食所導(dǎo)致的營養(yǎng)不良,超重和肥胖以及相關(guān)并發(fā)癥等疾病,。 由于環(huán)境污染等因素,,兒童腫瘤患病率增加。良性軟組織腫瘤是兒童最常見的良性腫瘤,。惡性腫瘤中,,以淋巴、造血系統(tǒng)和有關(guān)組織腫瘤占首位,,其次為起源于胚胎組織的神經(jīng)母細(xì)胞瘤,。兒童動態(tài)未定和未知腫瘤以顱內(nèi)及椎管內(nèi)腫瘤占首位。腫瘤是國家關(guān)注的重點領(lǐng)域,,研發(fā)兒童腫瘤有望獲得加快審批等政策扶持,。 此外,雙重特殊兒童的數(shù)量增加值得關(guān)注,。雙重特殊兒童,,是指那些在某些領(lǐng)域擁有超常能力,但同時又伴有某些障礙的兒童,。這些兒童智力或能力超過正常人但身心有缺陷,,如聽力障礙、視覺障礙,、肢體殘疾,、語言障礙、情緒情感異常等,。目前雙重特殊兒童研究主要集中在特殊學(xué)習(xí)障礙兒童,、注意缺陷多動障礙兒童和自閉癥兒童這三大類別上,藥物治療對以上類別兒童而言效果一般,,仍有進一步深挖的潛力,。 2、政策扶持:借鑒美國“他山之石” 美國通過實施《兒童最佳藥品法案》與《兒科研究公平法案》來激勵并強制兒科專用藥的臨床研究,。按照FDA批準(zhǔn)的書面請求完成兒科研究的專利藥品,,將被授予在其原有的專利期之后增加長達(dá)6個月的兒科獨占期的獎勵,。無法獲得兒科獨占期的非專利藥品,則依據(jù)規(guī)定給予一定數(shù)額的專項研究撥款,。此外,,新藥申請或補充申請時,除非經(jīng)FDA同意準(zhǔn)予延期或免除兒科評價,,否則都必須進行兒科評價,。 針對兒科專用藥研發(fā)困難、企業(yè)在某些領(lǐng)域研發(fā)積極性不高的狀況,,美國政府采取了與制藥企業(yè)合作研究開發(fā)兒科藥品臨床試驗的方式,,促進藥品的研發(fā)和審批程序,從而實現(xiàn)成果快速轉(zhuǎn)化,。 鑒于此,,我國政府也可主動探索與制藥企業(yè)在基礎(chǔ)研究和非專利藥兒科臨床試驗的合作,選擇兒科需求量較大但尚無兒科專用藥的非專利品種進行研究,。此外,,政府還可通過各類基金與企業(yè)簽訂合作開發(fā)協(xié)議,為特定兒科藥物的臨床研究提供技術(shù),、設(shè)施和資金支持,,合作中獲得的專利證書屬于政府和企業(yè)共同所有,允許企業(yè)保留專利,,并且企業(yè)可以利用該權(quán)利深入開發(fā)產(chǎn)品并推動產(chǎn)品上市,,加速研究成果的審批和商業(yè)化。 3,、營銷突圍:臨床證據(jù)挖掘和OTC布局 我國目前上市的兒科藥品主要是生產(chǎn)廠家數(shù)較多的化藥普藥和適應(yīng)癥基本相同的中成藥,。生產(chǎn)廠家數(shù)較多的兒科化藥普藥,通常上市時間都非常久,,臨床處方醫(yī)生對此類藥品都非常熟悉,,價格也由于多家競標(biāo)早已成為低價藥水平。這類藥品的生產(chǎn)廠家基本沒有推廣費用,,日常銷售主要靠自然銷售,也基本沒有突圍的需求,。 有推廣空間且有突圍需求的,,往往是價格維護較好且獨家的中成藥。此類藥品雖然有婦兒藥掛網(wǎng)采購的利好,,但在醫(yī)院覆蓋中往往受到醫(yī)院限制輔助用藥和中成藥等政策阻擊,,難以在醫(yī)院層面上有所作為。 進入臨床途徑或指南,,將是中成藥的主要突破點,,而這個突破點現(xiàn)在越來越講究臨床證據(jù),。因此,兒科中成藥營銷突圍首先就要做中藥再評價試驗,,挖掘臨床證據(jù),,證實其安全性和臨床使用的必要性,才能在醫(yī)院目錄中博得一席之地,。 此外,,生產(chǎn)廠家不妨盡早布局OTC終端,因為醫(yī)療資源緊缺將帶動部分家長為便利而在OTC購藥,。 不過,,生產(chǎn)廠家在進入OTC終端前,須根據(jù)產(chǎn)品特點和企業(yè)資源對產(chǎn)品進行更符合OTC銷售的品牌定位,,對產(chǎn)品進行二次開發(fā),,如產(chǎn)品的外觀設(shè)計、口感口味等,,這將有助于產(chǎn)品在OTC終端突圍,。生產(chǎn)廠家也可以考慮通過貼牌、并購等方式擴充自己的產(chǎn)品線,,通過系列組合方式整合各種差異化的產(chǎn)品,,推出整體品牌,發(fā)揮品牌的協(xié)同作用,,提升品牌的知曉度,。
 頭腦風(fēng)暴 政策,、立項,、營銷的對策 1、立項考量:關(guān)注兒童疾病譜變化 兒科藥品的立項首先要關(guān)注臨床需求,。隨著我國經(jīng)濟水平的發(fā)展,,兒童健康需求亦有所改變。我國目前學(xué)齡前兒童體格發(fā)育狀況良好,,低體質(zhì)量,、生長遲緩、消瘦發(fā)生率較低,,但超重及肥胖的發(fā)生率增高,,兒科藥品的開發(fā)可以關(guān)注由于偏食所導(dǎo)致的營養(yǎng)不良,超重和肥胖以及相關(guān)并發(fā)癥等疾病,。 由于環(huán)境污染等因素,,兒童腫瘤患病率增加。良性軟組織腫瘤是兒童最常見的良性腫瘤,。惡性腫瘤中,,以淋巴、造血系統(tǒng)和有關(guān)組織腫瘤占首位,,其次為起源于胚胎組織的神經(jīng)母細(xì)胞瘤,。兒童動態(tài)未定和未知腫瘤以顱內(nèi)及椎管內(nèi)腫瘤占首位。腫瘤是國家關(guān)注的重點領(lǐng)域,,研發(fā)兒童腫瘤有望獲得加快審批等政策扶持,。 此外,雙重特殊兒童的數(shù)量增加值得關(guān)注,。雙重特殊兒童,,是指那些在某些領(lǐng)域擁有超常能力,但同時又伴有某些障礙的兒童,。這些兒童智力或能力超過正常人但身心有缺陷,,如聽力障礙、視覺障礙,、肢體殘疾,、語言障礙、情緒情感異常等,。目前雙重特殊兒童研究主要集中在特殊學(xué)習(xí)障礙兒童,、注意缺陷多動障礙兒童和自閉癥兒童這三大類別上,藥物治療對以上類別兒童而言效果一般,,仍有進一步深挖的潛力,。 2、政策扶持:借鑒美國“他山之石” 美國通過實施《兒童最佳藥品法案》與《兒科研究公平法案》來激勵并強制兒科專用藥的臨床研究,。按照FDA批準(zhǔn)的書面請求完成兒科研究的專利藥品,,將被授予在其原有的專利期之后增加長達(dá)6個月的兒科獨占期的獎勵,。無法獲得兒科獨占期的非專利藥品,則依據(jù)規(guī)定給予一定數(shù)額的專項研究撥款,。此外,,新藥申請或補充申請時,除非經(jīng)FDA同意準(zhǔn)予延期或免除兒科評價,,否則都必須進行兒科評價,。 針對兒科專用藥研發(fā)困難、企業(yè)在某些領(lǐng)域研發(fā)積極性不高的狀況,,美國政府采取了與制藥企業(yè)合作研究開發(fā)兒科藥品臨床試驗的方式,,促進藥品的研發(fā)和審批程序,從而實現(xiàn)成果快速轉(zhuǎn)化,。 鑒于此,,我國政府也可主動探索與制藥企業(yè)在基礎(chǔ)研究和非專利藥兒科臨床試驗的合作,選擇兒科需求量較大但尚無兒科專用藥的非專利品種進行研究,。此外,,政府還可通過各類基金與企業(yè)簽訂合作開發(fā)協(xié)議,為特定兒科藥物的臨床研究提供技術(shù),、設(shè)施和資金支持,,合作中獲得的專利證書屬于政府和企業(yè)共同所有,允許企業(yè)保留專利,,并且企業(yè)可以利用該權(quán)利深入開發(fā)產(chǎn)品并推動產(chǎn)品上市,,加速研究成果的審批和商業(yè)化。 3,、營銷突圍:臨床證據(jù)挖掘和OTC布局 我國目前上市的兒科藥品主要是生產(chǎn)廠家數(shù)較多的化藥普藥和適應(yīng)癥基本相同的中成藥,。生產(chǎn)廠家數(shù)較多的兒科化藥普藥,通常上市時間都非常久,,臨床處方醫(yī)生對此類藥品都非常熟悉,,價格也由于多家競標(biāo)早已成為低價藥水平。這類藥品的生產(chǎn)廠家基本沒有推廣費用,,日常銷售主要靠自然銷售,也基本沒有突圍的需求,。 有推廣空間且有突圍需求的,,往往是價格維護較好且獨家的中成藥。此類藥品雖然有婦兒藥掛網(wǎng)采購的利好,,但在醫(yī)院覆蓋中往往受到醫(yī)院限制輔助用藥和中成藥等政策阻擊,,難以在醫(yī)院層面上有所作為。 進入臨床途徑或指南,,將是中成藥的主要突破點,,而這個突破點現(xiàn)在越來越講究臨床證據(jù),。因此,兒科中成藥營銷突圍首先就要做中藥再評價試驗,,挖掘臨床證據(jù),,證實其安全性和臨床使用的必要性,才能在醫(yī)院目錄中博得一席之地,。 此外,,生產(chǎn)廠家不妨盡早布局OTC終端,因為醫(yī)療資源緊缺將帶動部分家長為便利而在OTC購藥,。 不過,,生產(chǎn)廠家在進入OTC終端前,須根據(jù)產(chǎn)品特點和企業(yè)資源對產(chǎn)品進行更符合OTC銷售的品牌定位,,對產(chǎn)品進行二次開發(fā),,如產(chǎn)品的外觀設(shè)計、口感口味等,,這將有助于產(chǎn)品在OTC終端突圍,。生產(chǎn)廠家也可以考慮通過貼牌、并購等方式擴充自己的產(chǎn)品線,,通過系列組合方式整合各種差異化的產(chǎn)品,,推出整體品牌,發(fā)揮品牌的協(xié)同作用,,提升品牌的知曉度,。
頭腦風(fēng)暴 政策,、立項,、營銷的對策 1、立項考量:關(guān)注兒童疾病譜變化 兒科藥品的立項首先要關(guān)注臨床需求,。隨著我國經(jīng)濟水平的發(fā)展,,兒童健康需求亦有所改變。我國目前學(xué)齡前兒童體格發(fā)育狀況良好,,低體質(zhì)量,、生長遲緩、消瘦發(fā)生率較低,,但超重及肥胖的發(fā)生率增高,,兒科藥品的開發(fā)可以關(guān)注由于偏食所導(dǎo)致的營養(yǎng)不良,超重和肥胖以及相關(guān)并發(fā)癥等疾病,。 由于環(huán)境污染等因素,,兒童腫瘤患病率增加。良性軟組織腫瘤是兒童最常見的良性腫瘤,。惡性腫瘤中,,以淋巴、造血系統(tǒng)和有關(guān)組織腫瘤占首位,,其次為起源于胚胎組織的神經(jīng)母細(xì)胞瘤,。兒童動態(tài)未定和未知腫瘤以顱內(nèi)及椎管內(nèi)腫瘤占首位。腫瘤是國家關(guān)注的重點領(lǐng)域,,研發(fā)兒童腫瘤有望獲得加快審批等政策扶持,。 此外,雙重特殊兒童的數(shù)量增加值得關(guān)注,。雙重特殊兒童,,是指那些在某些領(lǐng)域擁有超常能力,但同時又伴有某些障礙的兒童,。這些兒童智力或能力超過正常人但身心有缺陷,,如聽力障礙、視覺障礙,、肢體殘疾,、語言障礙、情緒情感異常等,。目前雙重特殊兒童研究主要集中在特殊學(xué)習(xí)障礙兒童,、注意缺陷多動障礙兒童和自閉癥兒童這三大類別上,藥物治療對以上類別兒童而言效果一般,,仍有進一步深挖的潛力,。 2、政策扶持:借鑒美國“他山之石” 美國通過實施《兒童最佳藥品法案》與《兒科研究公平法案》來激勵并強制兒科專用藥的臨床研究,。按照FDA批準(zhǔn)的書面請求完成兒科研究的專利藥品,,將被授予在其原有的專利期之后增加長達(dá)6個月的兒科獨占期的獎勵,。無法獲得兒科獨占期的非專利藥品,則依據(jù)規(guī)定給予一定數(shù)額的專項研究撥款,。此外,,新藥申請或補充申請時,除非經(jīng)FDA同意準(zhǔn)予延期或免除兒科評價,,否則都必須進行兒科評價,。 針對兒科專用藥研發(fā)困難、企業(yè)在某些領(lǐng)域研發(fā)積極性不高的狀況,,美國政府采取了與制藥企業(yè)合作研究開發(fā)兒科藥品臨床試驗的方式,,促進藥品的研發(fā)和審批程序,從而實現(xiàn)成果快速轉(zhuǎn)化,。 鑒于此,,我國政府也可主動探索與制藥企業(yè)在基礎(chǔ)研究和非專利藥兒科臨床試驗的合作,選擇兒科需求量較大但尚無兒科專用藥的非專利品種進行研究,。此外,,政府還可通過各類基金與企業(yè)簽訂合作開發(fā)協(xié)議,為特定兒科藥物的臨床研究提供技術(shù),、設(shè)施和資金支持,,合作中獲得的專利證書屬于政府和企業(yè)共同所有,允許企業(yè)保留專利,,并且企業(yè)可以利用該權(quán)利深入開發(fā)產(chǎn)品并推動產(chǎn)品上市,,加速研究成果的審批和商業(yè)化。 3,、營銷突圍:臨床證據(jù)挖掘和OTC布局 我國目前上市的兒科藥品主要是生產(chǎn)廠家數(shù)較多的化藥普藥和適應(yīng)癥基本相同的中成藥,。生產(chǎn)廠家數(shù)較多的兒科化藥普藥,通常上市時間都非常久,,臨床處方醫(yī)生對此類藥品都非常熟悉,,價格也由于多家競標(biāo)早已成為低價藥水平。這類藥品的生產(chǎn)廠家基本沒有推廣費用,,日常銷售主要靠自然銷售,也基本沒有突圍的需求,。 有推廣空間且有突圍需求的,,往往是價格維護較好且獨家的中成藥。此類藥品雖然有婦兒藥掛網(wǎng)采購的利好,,但在醫(yī)院覆蓋中往往受到醫(yī)院限制輔助用藥和中成藥等政策阻擊,,難以在醫(yī)院層面上有所作為。 進入臨床途徑或指南,,將是中成藥的主要突破點,,而這個突破點現(xiàn)在越來越講究臨床證據(jù),。因此,兒科中成藥營銷突圍首先就要做中藥再評價試驗,,挖掘臨床證據(jù),,證實其安全性和臨床使用的必要性,才能在醫(yī)院目錄中博得一席之地,。 此外,,生產(chǎn)廠家不妨盡早布局OTC終端,因為醫(yī)療資源緊缺將帶動部分家長為便利而在OTC購藥,。 不過,,生產(chǎn)廠家在進入OTC終端前,須根據(jù)產(chǎn)品特點和企業(yè)資源對產(chǎn)品進行更符合OTC銷售的品牌定位,,對產(chǎn)品進行二次開發(fā),,如產(chǎn)品的外觀設(shè)計、口感口味等,,這將有助于產(chǎn)品在OTC終端突圍,。生產(chǎn)廠家也可以考慮通過貼牌、并購等方式擴充自己的產(chǎn)品線,,通過系列組合方式整合各種差異化的產(chǎn)品,,推出整體品牌,發(fā)揮品牌的協(xié)同作用,,提升品牌的知曉度,。






