近年來(lái),,我國(guó)醫(yī)療器械高速發(fā)展,,增速遠(yuǎn)超全球水平,,但規(guī)模、技術(shù)與國(guó)際市場(chǎng)還有很大差距,。國(guó)家出臺(tái)了一系列有利政策,,從三個(gè)環(huán)節(jié)上提升國(guó)產(chǎn)醫(yī)療器械創(chuàng)新能力、實(shí)現(xiàn)國(guó)產(chǎn)化替代——扶持產(chǎn)品研發(fā),、加快產(chǎn)品上市,、鼓勵(lì)產(chǎn)品采購(gòu)。
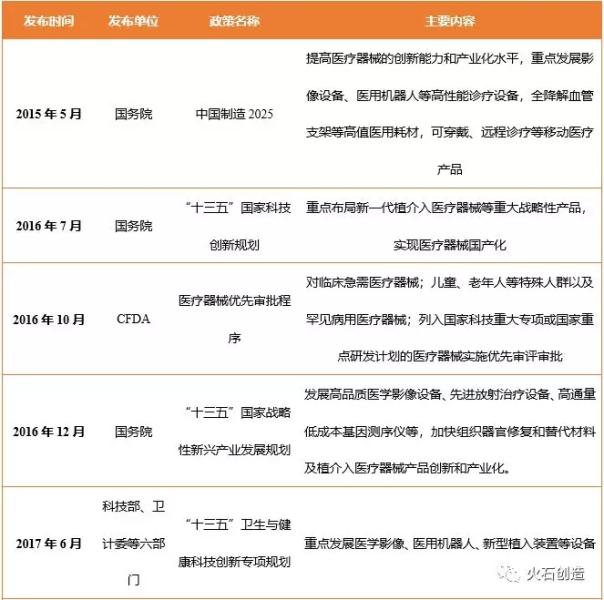
2015年國(guó)務(wù)院印發(fā)的《中國(guó)制造2025》強(qiáng)“生物醫(yī)藥及高性能醫(yī)療器械”列為重點(diǎn)突破發(fā)展的十大領(lǐng)域之一,,提出“提高醫(yī)療器械的創(chuàng)新能力和產(chǎn)業(yè)化水平,,重點(diǎn)發(fā)展影像設(shè)備、醫(yī)用機(jī)器人等高性能診療設(shè)備,,全降解血管支架等高值醫(yī)用耗材,可穿戴,、遠(yuǎn)程診療等移動(dòng)醫(yī)療產(chǎn)品”,,這也被認(rèn)為是國(guó)家明確要推進(jìn)高端醫(yī)療器械國(guó)產(chǎn)化替代的信號(hào)。
國(guó)家近三年也不斷鼓勵(lì)和促進(jìn)醫(yī)療器械的創(chuàng)新發(fā)展,,從“十三五”戰(zhàn)略規(guī)劃等頂層設(shè)計(jì)逐步向下落實(shí)到了具體政策,,不斷強(qiáng)調(diào)發(fā)展創(chuàng)新醫(yī)療器械的重要意義。
表1 醫(yī)療器械國(guó)產(chǎn)化相關(guān)政策

從宏觀上來(lái)看,,國(guó)家在三個(gè)環(huán)節(jié)上實(shí)行舉措來(lái)提升國(guó)產(chǎn)醫(yī)療器械創(chuàng)新能力,、實(shí)現(xiàn)國(guó)產(chǎn)化替代——扶持產(chǎn)品研發(fā)、加快產(chǎn)品上市,、鼓勵(lì)產(chǎn)品采購(gòu),。
扶持產(chǎn)品研發(fā)
在醫(yī)療器械研發(fā)的環(huán)節(jié),國(guó)家通過(guò)對(duì)重點(diǎn)研發(fā)計(jì)劃等重大專項(xiàng)的扶持來(lái)提升我國(guó)醫(yī)療器械產(chǎn)業(yè)自主研發(fā)技術(shù)水平,,促進(jìn)產(chǎn)業(yè)轉(zhuǎn)型升級(jí),、培育新的經(jīng)濟(jì)增長(zhǎng)點(diǎn)。
2015年,,科技部聯(lián)合衛(wèi)計(jì)委,、工信部、食藥監(jiān),、衛(wèi)生部等部門,,將科技部管理的國(guó)家重點(diǎn)基礎(chǔ)研究發(fā)展計(jì)劃、國(guó)家高技術(shù)研究發(fā)展計(jì)劃等13個(gè)部門管理的公益性行業(yè)科研專項(xiàng)整合形成了國(guó)家重點(diǎn)研發(fā)計(jì)劃,,并且啟動(dòng)了包括了“數(shù)字診療設(shè)備”,、“生物醫(yī)用材料研發(fā)與組織器官修復(fù)替代”等與高端醫(yī)療器械相關(guān)專項(xiàng)的試點(diǎn)工作。
此外,,醫(yī)療器械注冊(cè)人制度試點(diǎn)也已經(jīng)從最開(kāi)始的上海擴(kuò)展到了廣東和天津兩地,,該制度的落地意味著,將以往醫(yī)療器械注冊(cè)和生產(chǎn)解綁,能在無(wú)形中不斷將研發(fā)創(chuàng)新和規(guī)?;a(chǎn)等要素進(jìn)行合理配置,,激發(fā)醫(yī)療器械創(chuàng)業(yè)創(chuàng)新發(fā)展的活力,使得醫(yī)療器械創(chuàng)新者能夠?qū)W⒂诋a(chǎn)品研發(fā),。
加快產(chǎn)品上市
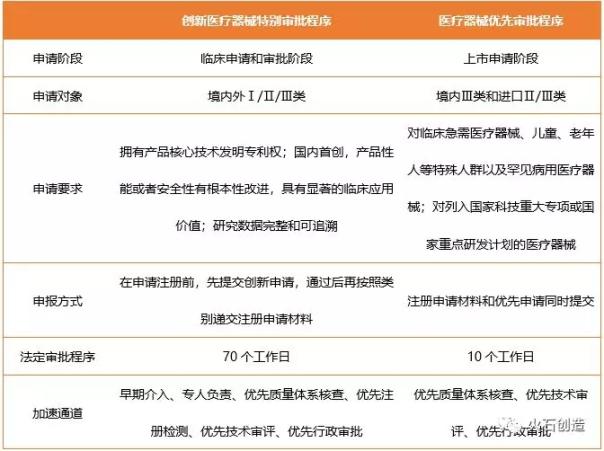
為了集中力量加快醫(yī)療器械的上市效率,,原國(guó)家食品藥品監(jiān)督管理局(原CFDA)分別在2014年3月和2017年1月開(kāi)始實(shí)施創(chuàng)新醫(yī)療器械特別審批程序和醫(yī)療器械優(yōu)先審批程序。
兩者對(duì)產(chǎn)品的申報(bào)要求有所不同,,但最主要的區(qū)別在去申報(bào)方式,,創(chuàng)新醫(yī)療器械特別審批程序針對(duì)的是臨床申請(qǐng)和審批階段的產(chǎn)品,被納入的產(chǎn)品可獲得研發(fā)和后續(xù)優(yōu)先審批的待遇,,還需要進(jìn)一步提交上市申請(qǐng),,而醫(yī)療器械優(yōu)先審批程序針對(duì)的是上市申請(qǐng)階段的產(chǎn)品,需要同時(shí)提交注冊(cè)申請(qǐng)材料和優(yōu)先申請(qǐng),。
表2 創(chuàng)新醫(yī)療器械特別審批和醫(yī)療器械優(yōu)先審批的區(qū)別
自2014年創(chuàng)新醫(yī)療器械特別審批程序正式實(shí)施以來(lái),,截至目前(2018年第13批)已經(jīng)有200個(gè)產(chǎn)品被納入該程序,其中有40個(gè)產(chǎn)品已經(jīng)獲批上市,;醫(yī)療器械優(yōu)先審批程序自2017年1月1日正式實(shí)施以來(lái),,也已將20個(gè)產(chǎn)品納入名單,并且到目前為止已經(jīng)有5個(gè)產(chǎn)品獲批上市,。
鼓勵(lì)產(chǎn)品采購(gòu)
國(guó)家衛(wèi)健委有關(guān)負(fù)責(zé)人在此前與網(wǎng)民在線交流醫(yī)療設(shè)備問(wèn)題時(shí)表示要嚴(yán)格執(zhí)行政府采購(gòu)法,,確保財(cái)政資金有限采購(gòu)國(guó)產(chǎn)醫(yī)療設(shè)備。同時(shí),,衛(wèi)健委還將制定和完善醫(yī)療衛(wèi)生機(jī)構(gòu)裝備標(biāo)準(zhǔn),,知道醫(yī)療衛(wèi)生機(jī)構(gòu)按功能定位合理配置適宜的醫(yī)療設(shè)備,推進(jìn)發(fā)展應(yīng)用國(guó)產(chǎn)醫(yī)療設(shè)備,。
遴選“優(yōu)秀國(guó)產(chǎn)醫(yī)療設(shè)備”名單,。2014年以來(lái),在國(guó)家衛(wèi)計(jì)委規(guī)劃與信息司的委托下,,中國(guó)醫(yī)學(xué)裝備協(xié)會(huì)開(kāi)展了優(yōu)秀國(guó)產(chǎn)醫(yī)療設(shè)備的遴選工作,,截至目前已經(jīng)公布了四批“優(yōu)秀國(guó)產(chǎn)醫(yī)療設(shè)備”的企業(yè)和產(chǎn)品,已經(jīng)有超過(guò)800款醫(yī)療器械入選了《優(yōu)秀國(guó)產(chǎn)醫(yī)療設(shè)備遴選品目錄》,,為醫(yī)院采購(gòu)國(guó)產(chǎn)設(shè)備提供參考,,也為進(jìn)口替代指明了方向。
“首臺(tái)套”政策助力設(shè)備進(jìn)入市場(chǎng),。首臺(tái)(套)重大技術(shù)裝備(“首臺(tái)套”)是指國(guó)內(nèi)實(shí)現(xiàn)重大技術(shù)突破,、擁有知識(shí)產(chǎn)權(quán)、尚未取得市場(chǎng)業(yè)績(jī)的裝備產(chǎn)品,,包括前三臺(tái)(套)或批(次)成套設(shè)備,、整機(jī)設(shè)備及核心部件,、控制系統(tǒng)、基礎(chǔ)材料,、軟件系統(tǒng)等,。2015年財(cái)政部、工信部和保監(jiān)會(huì)聯(lián)合發(fā)布的《關(guān)于開(kāi)展首臺(tái)(套)重大技術(shù)裝備保險(xiǎn)補(bǔ)償機(jī)制試點(diǎn)工作的通知》啟動(dòng)了首臺(tái)(套)重大技術(shù)裝備保險(xiǎn)補(bǔ)償機(jī)制的試點(diǎn)工作,。為了保障相關(guān)設(shè)備能夠順利進(jìn)入醫(yī)療機(jī)構(gòu),,政府與保險(xiǎn)公司合作為目錄內(nèi)的裝備制定綜合險(xiǎn),裝備制造業(yè)投保,,中央財(cái)政適當(dāng)補(bǔ)貼投保企業(yè)的保費(fèi),。同時(shí),政策要求政府在采購(gòu)中優(yōu)先,、鼓勵(lì)采購(gòu)首臺(tái)套創(chuàng)新產(chǎn)品,,并明確規(guī)定納入首臺(tái)套目錄的產(chǎn)品投標(biāo)時(shí),招標(biāo)單位不得對(duì)其提出市占率,、使用業(yè)績(jī)等的要求,,不得對(duì)其套用特定產(chǎn)品設(shè)置評(píng)價(jià)標(biāo)準(zhǔn)、技術(shù)參數(shù)等,,不得以不合理?xiàng)l件限制或排斥首臺(tái)套產(chǎn)品參與投標(biāo)。2017年7月和2018年4月,,發(fā)改委等8部門又先后兩次發(fā)布《關(guān)于促進(jìn)首臺(tái)(套)重大技術(shù)裝備示范應(yīng)用的意見(jiàn)》,,以首臺(tái)套示范應(yīng)用為突破口,推動(dòng)重大技術(shù)裝備水平整體提升,。首臺(tái)(套)政策將幫助國(guó)產(chǎn)設(shè)備打開(kāi)市場(chǎng),,提高國(guó)產(chǎn)化替代的進(jìn)程。
多地政府采購(gòu)文件限制進(jìn)口,,鼓勵(lì)國(guó)產(chǎn),。目前,為了鼓勵(lì)國(guó)產(chǎn)設(shè)備國(guó)產(chǎn)化替代,,已有包括廣東,、浙江和四川等多地政府在采購(gòu)文件中提出限制采購(gòu)進(jìn)口產(chǎn)品,鼓勵(lì)采購(gòu)國(guó)產(chǎn)設(shè)備,。隨著當(dāng)前這些政策的落實(shí)以及更多省市對(duì)類似文件的推行,,將在很大程度上加快國(guó)產(chǎn)化的替代速度。
表3 各地限制進(jìn)口鼓勵(lì)國(guó)產(chǎn)相關(guān)文件或政策








