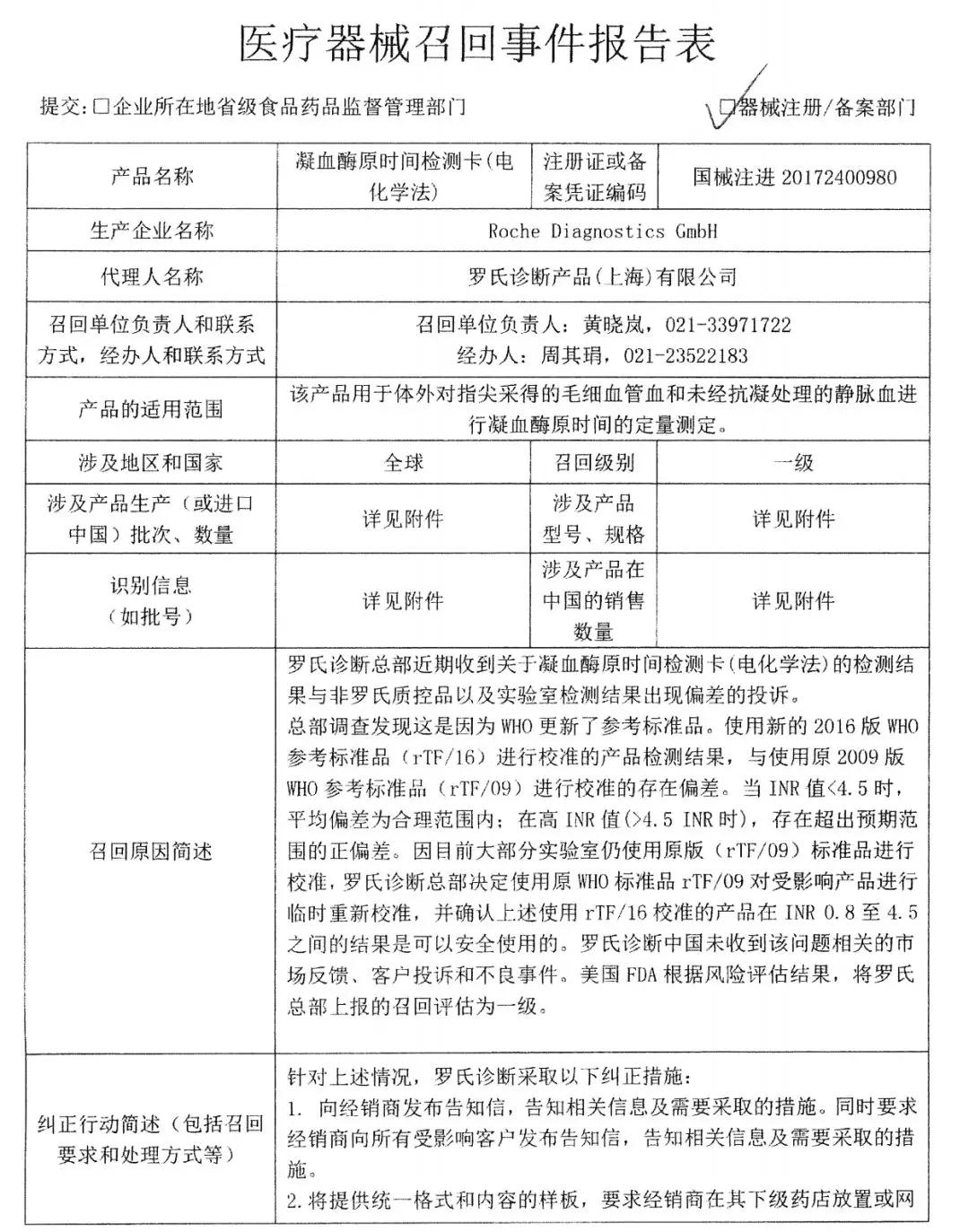
12月26日,國家衛(wèi)生健康委員會發(fā)布通報,,稱收到國家藥監(jiān)局來函,,通報了羅氏診斷產(chǎn)品(上海)有限公司凝血酶原時間檢測卡(電化學(xué)法)部分產(chǎn)品召回有關(guān)情況,。要求及時通知各醫(yī)療機(jī)構(gòu)做好相關(guān)型號、規(guī)格及批次的凝血酶原時間檢測卡(電化學(xué)法)的召回工作,,保證醫(yī)療質(zhì)量和醫(yī)療安全,。
醫(yī)療器械召回事件報告表顯示,羅氏診斷總部調(diào)查發(fā)現(xiàn)這是因為WHO更新了參考標(biāo)準(zhǔn)品,。美國FDA根據(jù)風(fēng)險評估結(jié)果,,將此召回評估為一級。
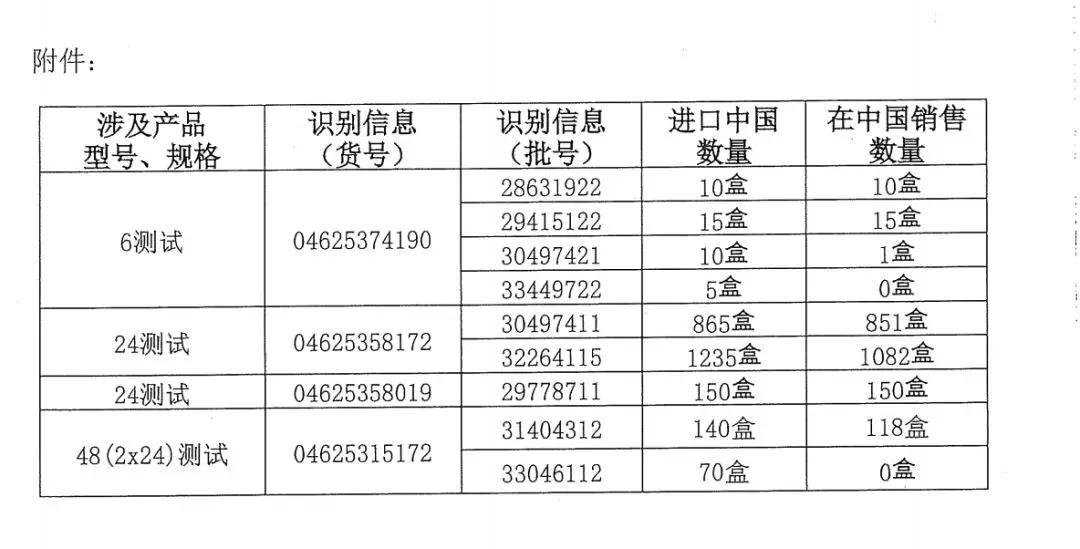
報表顯示,,所召回的產(chǎn)品共涉及4個產(chǎn)品型號,,9個批次,進(jìn)口到中國的數(shù)量共2500盒,。
羅氏診斷稱,,針對上述情況,采取以下糾正措施:
1,、向經(jīng)銷商發(fā)布告知信,,告知相關(guān)信息及需要采取的措施。同時要求經(jīng)銷商向所有受影響客戶發(fā)布告知信,,告知相關(guān)信息及需要采取的措施,。
2、將提供統(tǒng)一格式和樣板,,要求經(jīng)銷商在其線下藥店或網(wǎng)店發(fā)布召回信息,。
3、將在公司官網(wǎng)上公布事件相關(guān)信息,。
4,、將在后續(xù)發(fā)貨的所有凝血酶原時間檢測卡(電化學(xué)法)產(chǎn)品中加放
《致客戶信》,告知事件的相關(guān)信息及要采取的措施,。
5,、羅氏診斷總部將使用原WO標(biāo)準(zhǔn)品rTF/09對凝血酶原時間檢測卡
(電化學(xué)法)進(jìn)行臨時重新校準(zhǔn),。
附:醫(yī)療器械召回事件報告表