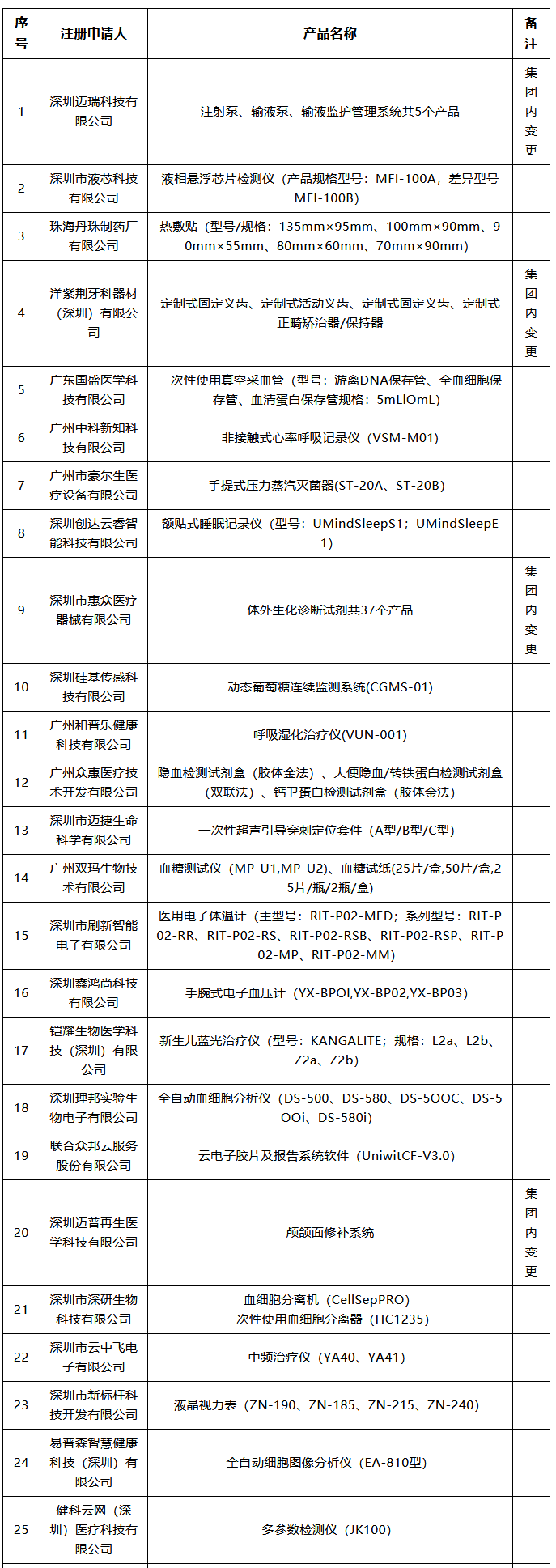
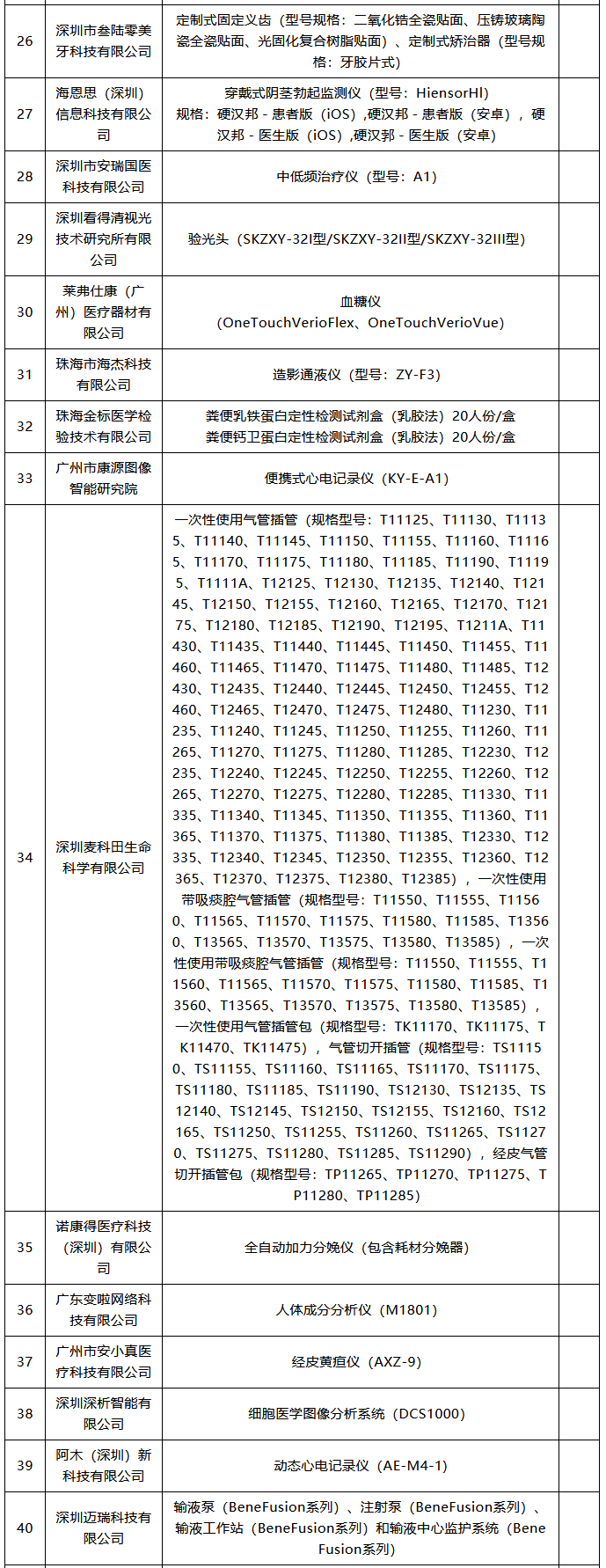
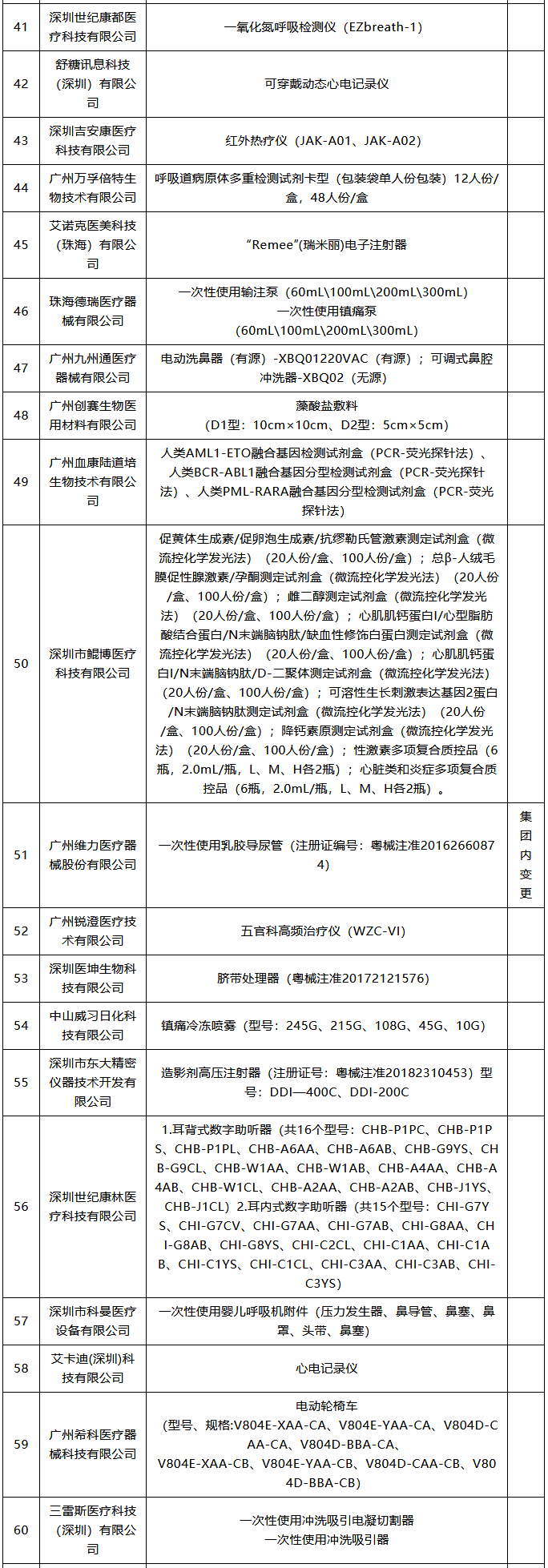
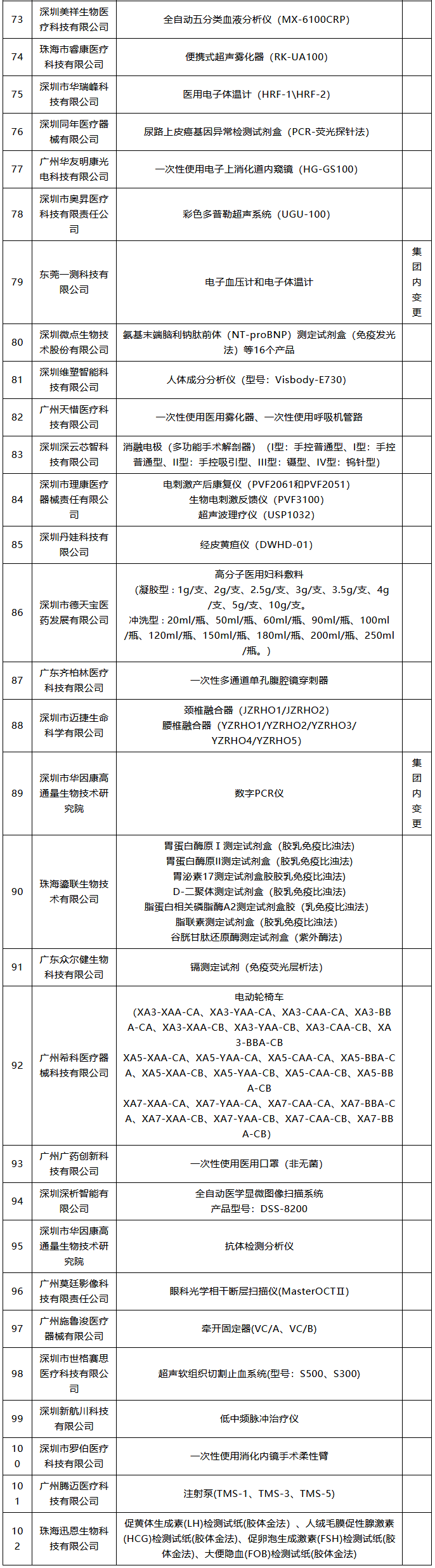
潤(rùn)寶醫(yī)療網(wǎng)11月26日訊 醫(yī)療器械注冊(cè)人制度試點(diǎn)擴(kuò)大 11月18日,,廣東省藥監(jiān)局發(fā)布最新版《廣東省醫(yī)療器械注冊(cè)人試點(diǎn)品種清單》,。據(jù)賽柏藍(lán)器械觀察,目前全國(guó)已有多個(gè)省份在申請(qǐng)加入醫(yī)療器械注冊(cè)人制度試點(diǎn),,踴躍程度超過(guò)預(yù)期,。 什么是醫(yī)療注冊(cè)人制度,經(jīng)歷了怎樣的變革,? 此前,,在2014年10月起實(shí)施的《醫(yī)療器械生產(chǎn)監(jiān)督管理辦法》中明確規(guī)定,拿到醫(yī)療器械注冊(cè)證才能申請(qǐng)第二類(lèi),、第三類(lèi)醫(yī)療器械的生產(chǎn)許可證,,而取得生產(chǎn)許可才能生產(chǎn)、受托生產(chǎn)相應(yīng)醫(yī)療器械,。即把注冊(cè)與生產(chǎn)許可捆綁在一起,,必須由一個(gè)主體來(lái)完成,。 現(xiàn)在,,醫(yī)療器械注冊(cè)人制度發(fā)生改革,允許企業(yè),、機(jī)構(gòu)和人員單獨(dú)申請(qǐng)醫(yī)療器械注冊(cè)證,,再以注冊(cè)人的身份委托其他企業(yè)生產(chǎn)相應(yīng)的醫(yī)療器械。即注冊(cè)和生產(chǎn)許可可以不由一個(gè)主體來(lái)完成,。 “注冊(cè)人制度實(shí)現(xiàn)了產(chǎn)品注冊(cè)和生產(chǎn)許可的解綁,,更利于鼓勵(lì)創(chuàng)新、整合社會(huì)資源,、加快醫(yī)療器械產(chǎn)品上市”,,上海市藥監(jiān)局醫(yī)療器械監(jiān)管處處長(zhǎng)林森勇認(rèn)為。 從全國(guó)來(lái)看,,注冊(cè)人制度先行于上海,、廣東、天津三地自貿(mào)區(qū),,隨后天津,、北京等地也“入局”。 2017年3月,,國(guó)務(wù)院印發(fā)的《全面深化中國(guó)(上海)自由貿(mào)易試驗(yàn)區(qū)改革開(kāi)放方案》提出,,要優(yōu)化創(chuàng)新要素的市場(chǎng)配置機(jī)制,允許自貿(mào)試驗(yàn)區(qū)內(nèi)醫(yī)療器械注冊(cè)申請(qǐng)人委托上海市醫(yī)療器械生產(chǎn)企業(yè)生產(chǎn)產(chǎn)品,。 2017年10月,,中辦,、國(guó)辦印發(fā)的《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見(jiàn)》明確,推動(dòng)上市許可持有人制度全面實(shí)施,。允許醫(yī)療器械研發(fā)機(jī)構(gòu)和科研人員申請(qǐng)醫(yī)療器械上市許可,。 2017年12月,原上海市食品藥品監(jiān)管局發(fā)布了關(guān)于實(shí)施《中國(guó)(上海)自由貿(mào)易試驗(yàn)區(qū)內(nèi)醫(yī)療器械注冊(cè)人制度試點(diǎn)工作實(shí)施方案》的通知,。2018年7月,,上海市藥監(jiān)部門(mén)將試點(diǎn)擴(kuò)大到上海全市。 2018年5月,,國(guó)務(wù)院印發(fā)的《進(jìn)一步深化中國(guó)(廣東),、(天津)、(福建)自由貿(mào)易試驗(yàn)區(qū)改革開(kāi)放方案》明確,,允許廣東自貿(mào)試驗(yàn)區(qū)內(nèi)醫(yī)療器械注冊(cè)申請(qǐng)人委托廣東省醫(yī)療器械生產(chǎn)企業(yè)生產(chǎn)產(chǎn)品,;允許天津自貿(mào)試驗(yàn)區(qū)內(nèi)醫(yī)療器械注冊(cè)申請(qǐng)人委托天津市醫(yī)療器械生產(chǎn)企業(yè)生產(chǎn)產(chǎn)品。 2018年8月,,國(guó)家藥監(jiān)局發(fā)布《關(guān)于同意開(kāi)展醫(yī)療器械注冊(cè)人制度試點(diǎn)工作的批復(fù)》,,同意在中國(guó)(廣東)自由貿(mào)易試驗(yàn)區(qū)以及廣州、深圳,、珠海,,中國(guó)(天津)自由貿(mào)易試驗(yàn)區(qū)內(nèi)開(kāi)展注冊(cè)人制度試點(diǎn)工作。 2018年8月,,天津市市場(chǎng)和質(zhì)量監(jiān)督管理委員會(huì)發(fā)布關(guān)于印發(fā)《中國(guó)(天津)自由貿(mào)易試驗(yàn)區(qū)內(nèi)醫(yī)療器械注冊(cè)人制度試點(diǎn)工作實(shí)施方案》的通知,,將醫(yī)療器械注冊(cè)人制度進(jìn)一步擴(kuò)展至天津。 2019年2月,,國(guó)務(wù)院下發(fā)了《關(guān)于全面推進(jìn)北京市服務(wù)業(yè)擴(kuò)大開(kāi)展綜合試點(diǎn)工作方案》的批復(fù),,明確寫(xiě)道:開(kāi)展醫(yī)療器械注冊(cè)人制度試點(diǎn),允許北京市醫(yī)療器械注冊(cè)人委托京津冀地區(qū)醫(yī)療器械生產(chǎn)企業(yè)生產(chǎn)醫(yī)療器械,。 2020年多地均開(kāi)始以通告形式發(fā)布“醫(yī)療器械注冊(cè)人制度試點(diǎn)工作申請(qǐng)要求和申報(bào)程序”,,推進(jìn)醫(yī)療器械注冊(cè)人制度試點(diǎn)工作,強(qiáng)化服務(wù)指導(dǎo),,規(guī)范審批程序,,促進(jìn)轄區(qū)醫(yī)療器械產(chǎn)業(yè)創(chuàng)新發(fā)展。 目前各地實(shí)施的結(jié)果來(lái)看,,注冊(cè)人制度試點(diǎn)工作取得一定成效,,但還存在一定問(wèn)題。 比如一些企業(yè)將注冊(cè)人制度簡(jiǎn)單理解為委托生產(chǎn),,沒(méi)有意識(shí)到注冊(cè)人要對(duì)醫(yī)療器械全生命周期的質(zhì)量管理承擔(dān)主體責(zé)任,;有些企業(yè)為享受試點(diǎn)期間的鼓勵(lì)政策(如優(yōu)先審評(píng)等),刻意拆分出持證人或受托人;部分持有人和委托人之間產(chǎn)生知識(shí)產(chǎn)權(quán)糾紛等,。 需要看到的是,,由于目前試點(diǎn)范圍的局限性,醫(yī)療器械注冊(cè)人制度雖然不斷釋放紅利,,但是速率方面還需加強(qiáng),。 102款獲批器械名單