潤(rùn)寶醫(yī)療網(wǎng)4月8日訊 3月18日,為了保證醫(yī)療器械的安全、有效,,保障人體健康和生命安全,促進(jìn)醫(yī)療器械產(chǎn)業(yè)發(fā)展,,新修訂的《醫(yī)療器械監(jiān)督管理?xiàng)l例》(以下簡(jiǎn)稱“新《條例》”)正式發(fā)布,,將于2021年6月1日起實(shí)施。監(jiān)管條例的修訂在一定程度上影響著醫(yī)療器械行業(yè)的發(fā)展,,通過(guò)解讀新《條例》,,筆者發(fā)現(xiàn),這是國(guó)家首次賦予了實(shí)驗(yàn)室自建檢測(cè)(Laboratory developed test,,LDTs)合法性,,這將重大利好ICL行業(yè)。 01,、醫(yī)療器械監(jiān)督管理?xiàng)l例的修訂歷史 中國(guó)《醫(yī)療器械監(jiān)督管理?xiàng)l例》第一版出臺(tái)于2000年,,分別于2014、2017和2021年進(jìn)行了修訂。2014年曾對(duì)《條例》進(jìn)行了大幅度的修訂,,2017年則在2014年修訂版的基礎(chǔ)上進(jìn)行補(bǔ)充,。時(shí)隔6年,2020年12月21日再次在國(guó)務(wù)院第119次常務(wù)會(huì)議上對(duì)《醫(yī)療器械監(jiān)督管理?xiàng)l例》進(jìn)行了全面的補(bǔ)充修訂,。 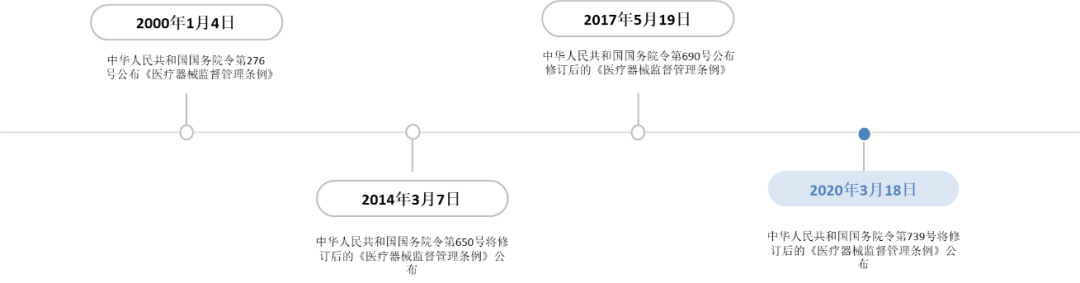 02什么是IVD,?IVD有哪些? 按照中國(guó)醫(yī)療器械研究院的劃分標(biāo)準(zhǔn),,醫(yī)療器械可以主要分為:高值醫(yī)用耗材,、低值醫(yī)用耗材、醫(yī)療設(shè)備,、IVD(體外診斷),。體外診斷(IVD)則是指通過(guò)對(duì)體外的人體樣本進(jìn)行檢驗(yàn)分析而獲取臨床診斷信息的一種診斷方法。體外檢驗(yàn)的人體樣本包括血液,、體液,、細(xì)胞以及組織等,其應(yīng)用領(lǐng)域包括常規(guī)生化項(xiàng)目的檢驗(yàn),、疾病檢測(cè)以及基因測(cè)序等,。體外診斷試劑是臨床診斷中不可或缺的要素,可為醫(yī)生和患者提供重要的診斷信息,。 按照檢測(cè)原理和應(yīng)用領(lǐng)域,,體外診斷可以分為生化診斷、免疫診斷,、分子診斷,、POCT四種。
02什么是IVD,?IVD有哪些? 按照中國(guó)醫(yī)療器械研究院的劃分標(biāo)準(zhǔn),,醫(yī)療器械可以主要分為:高值醫(yī)用耗材,、低值醫(yī)用耗材、醫(yī)療設(shè)備,、IVD(體外診斷),。體外診斷(IVD)則是指通過(guò)對(duì)體外的人體樣本進(jìn)行檢驗(yàn)分析而獲取臨床診斷信息的一種診斷方法。體外檢驗(yàn)的人體樣本包括血液,、體液,、細(xì)胞以及組織等,其應(yīng)用領(lǐng)域包括常規(guī)生化項(xiàng)目的檢驗(yàn),、疾病檢測(cè)以及基因測(cè)序等,。體外診斷試劑是臨床診斷中不可或缺的要素,可為醫(yī)生和患者提供重要的診斷信息,。 按照檢測(cè)原理和應(yīng)用領(lǐng)域,,體外診斷可以分為生化診斷、免疫診斷,、分子診斷,、POCT四種。 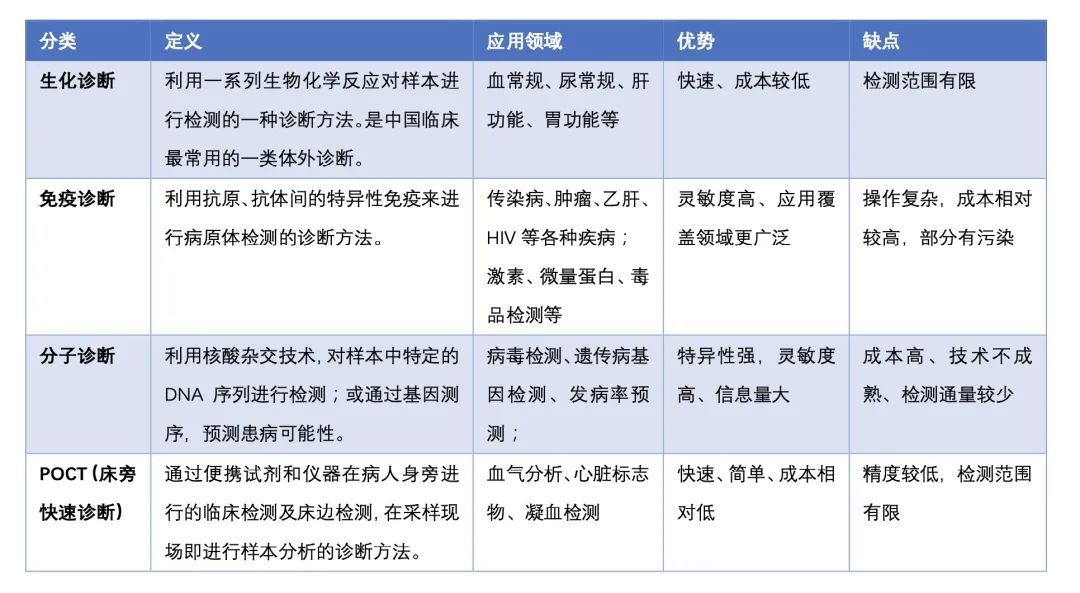 隨著IVD試劑產(chǎn)品種類不斷豐富,,技術(shù)水平不斷提高,,IVD試劑的應(yīng)用場(chǎng)景也不斷豐富,從傳統(tǒng)的醫(yī)院檢驗(yàn)科逐漸向第三方醫(yī)學(xué)診斷機(jī)構(gòu),、體檢中心和基層衛(wèi)生醫(yī)療機(jī)構(gòu)擴(kuò)張,。第三方醫(yī)學(xué)診斷機(jī)構(gòu)又稱為獨(dú)立醫(yī)學(xué)實(shí)驗(yàn)室(Independent Clinical Laboratory,ICL),,是指在衛(wèi)生行政部門的許可下,,具有獨(dú)立法人資格、獨(dú)立于醫(yī)院之外從事臨床檢驗(yàn)或病理診斷和服務(wù)并能獨(dú)立承擔(dān)責(zé)任的醫(yī)療機(jī)構(gòu),。 03,、本次條例修訂對(duì)IVD有什么影響? 2021版新《條例》第53條中明確規(guī)定,,對(duì)國(guó)內(nèi)尚無(wú)同品種產(chǎn)品上市的體外診斷試劑,,符合條件的醫(yī)療機(jī)構(gòu)根據(jù)本單位的臨床需要,可以自行研制,在執(zhí)業(yè)醫(yī)師指導(dǎo)下在本單位內(nèi)使用,。條例中的所說(shuō)的體外診斷試劑,,美國(guó)臨床病理學(xué)會(huì)(ASCP)統(tǒng)稱為實(shí)驗(yàn)室自建項(xiàng)目(Laboratory Developed Test,LDT),。 從監(jiān)管層面來(lái)區(qū)分,,IVD產(chǎn)品主要分為傳統(tǒng)IVD產(chǎn)品和LDT產(chǎn)品,傳統(tǒng)IVD指企業(yè)經(jīng)過(guò)研發(fā),、申報(bào),、上市、生產(chǎn)流程的標(biāo)準(zhǔn)化產(chǎn)品,,需要經(jīng)過(guò)一系列的審批流程,,上市時(shí)間比較長(zhǎng);LDT產(chǎn)品是指實(shí)驗(yàn)室內(nèi)部研發(fā),、檢測(cè)和使用,,以診斷為目的的產(chǎn)品。LDT僅能在研發(fā)的實(shí)驗(yàn)室內(nèi)使用,,可使用購(gòu)買或自制的試劑,但這些試劑不能銷售給其他實(shí)驗(yàn)室,、醫(yī)院或醫(yī)生,。一般是樣本量較小,工業(yè)企業(yè)研發(fā)性價(jià)比較低的產(chǎn)品,。
隨著IVD試劑產(chǎn)品種類不斷豐富,,技術(shù)水平不斷提高,,IVD試劑的應(yīng)用場(chǎng)景也不斷豐富,從傳統(tǒng)的醫(yī)院檢驗(yàn)科逐漸向第三方醫(yī)學(xué)診斷機(jī)構(gòu),、體檢中心和基層衛(wèi)生醫(yī)療機(jī)構(gòu)擴(kuò)張,。第三方醫(yī)學(xué)診斷機(jī)構(gòu)又稱為獨(dú)立醫(yī)學(xué)實(shí)驗(yàn)室(Independent Clinical Laboratory,ICL),,是指在衛(wèi)生行政部門的許可下,,具有獨(dú)立法人資格、獨(dú)立于醫(yī)院之外從事臨床檢驗(yàn)或病理診斷和服務(wù)并能獨(dú)立承擔(dān)責(zé)任的醫(yī)療機(jī)構(gòu),。 03,、本次條例修訂對(duì)IVD有什么影響? 2021版新《條例》第53條中明確規(guī)定,,對(duì)國(guó)內(nèi)尚無(wú)同品種產(chǎn)品上市的體外診斷試劑,,符合條件的醫(yī)療機(jī)構(gòu)根據(jù)本單位的臨床需要,可以自行研制,在執(zhí)業(yè)醫(yī)師指導(dǎo)下在本單位內(nèi)使用,。條例中的所說(shuō)的體外診斷試劑,,美國(guó)臨床病理學(xué)會(huì)(ASCP)統(tǒng)稱為實(shí)驗(yàn)室自建項(xiàng)目(Laboratory Developed Test,LDT),。 從監(jiān)管層面來(lái)區(qū)分,,IVD產(chǎn)品主要分為傳統(tǒng)IVD產(chǎn)品和LDT產(chǎn)品,傳統(tǒng)IVD指企業(yè)經(jīng)過(guò)研發(fā),、申報(bào),、上市、生產(chǎn)流程的標(biāo)準(zhǔn)化產(chǎn)品,,需要經(jīng)過(guò)一系列的審批流程,,上市時(shí)間比較長(zhǎng);LDT產(chǎn)品是指實(shí)驗(yàn)室內(nèi)部研發(fā),、檢測(cè)和使用,,以診斷為目的的產(chǎn)品。LDT僅能在研發(fā)的實(shí)驗(yàn)室內(nèi)使用,,可使用購(gòu)買或自制的試劑,但這些試劑不能銷售給其他實(shí)驗(yàn)室,、醫(yī)院或醫(yī)生,。一般是樣本量較小,工業(yè)企業(yè)研發(fā)性價(jià)比較低的產(chǎn)品,。  LDT是很多特殊檢驗(yàn)的搖籃,,對(duì)新領(lǐng)域、新技術(shù)檢測(cè)的發(fā)展有重大推進(jìn)作用,。近年來(lái),,隨著分子診斷和質(zhì)譜分析等新興技術(shù)的出現(xiàn)和迅猛發(fā)展,LDT已經(jīng)在國(guó)外個(gè)體化醫(yī)療和精準(zhǔn)化醫(yī)療中發(fā)揮出越來(lái)越大的作用,。此次修訂新《條例》,,是我國(guó)首次明確了LDT的合法地位。 放眼全球,,美國(guó)國(guó)會(huì)早已于1967年頒布第一部實(shí)驗(yàn)室管理法案《臨床試驗(yàn)改進(jìn)法案》(67版CLIA),,承認(rèn)了LDT原型的合法性。1990年至2015年,,F(xiàn)DA不斷完善和加強(qiáng)相關(guān)法規(guī)的建設(shè),,在此期間美國(guó)ICL行業(yè)快速發(fā)展,同時(shí)也推動(dòng)了質(zhì)譜和NGS特檢平臺(tái)的快速發(fā)展,。 LDT的特性決定了工業(yè)企業(yè)暫時(shí)無(wú)法大規(guī)模生產(chǎn),。目前國(guó)內(nèi)已有部分公立醫(yī)院實(shí)驗(yàn)室、獨(dú)立醫(yī)學(xué)實(shí)驗(yàn)室(ICL)在遺傳病診斷、腫瘤診斷,、藥物遺傳學(xué)診斷等領(lǐng)域開展LDT項(xiàng)目,。公立醫(yī)院面臨著患者有需求,但沒(méi)有足夠的樣本實(shí)現(xiàn)規(guī)?;?,也無(wú)法通過(guò)大樣本印證LDT方法學(xué)的科學(xué)性的困境。而迪安診斷,、金域醫(yī)學(xué)等內(nèi)資ICL經(jīng)歷了一輪較快的擴(kuò)張階段,,迪安診斷從2010年的8個(gè)實(shí)驗(yàn)室擴(kuò)張至2017年38個(gè);金域醫(yī)學(xué)從2010年14個(gè)增加至2017年37個(gè),。在初步經(jīng)歷了一段較快的擴(kuò)張時(shí)期,,沉淀了一定的高端設(shè)備和高級(jí)專業(yè)技術(shù)人員后,ICL在承擔(dān)LDT項(xiàng)目方面有天然的優(yōu)勢(shì),,或許在短期內(nèi)可通過(guò)和公立醫(yī)院合作實(shí)現(xiàn)共贏,。
LDT是很多特殊檢驗(yàn)的搖籃,,對(duì)新領(lǐng)域、新技術(shù)檢測(cè)的發(fā)展有重大推進(jìn)作用,。近年來(lái),,隨著分子診斷和質(zhì)譜分析等新興技術(shù)的出現(xiàn)和迅猛發(fā)展,LDT已經(jīng)在國(guó)外個(gè)體化醫(yī)療和精準(zhǔn)化醫(yī)療中發(fā)揮出越來(lái)越大的作用,。此次修訂新《條例》,,是我國(guó)首次明確了LDT的合法地位。 放眼全球,,美國(guó)國(guó)會(huì)早已于1967年頒布第一部實(shí)驗(yàn)室管理法案《臨床試驗(yàn)改進(jìn)法案》(67版CLIA),,承認(rèn)了LDT原型的合法性。1990年至2015年,,F(xiàn)DA不斷完善和加強(qiáng)相關(guān)法規(guī)的建設(shè),,在此期間美國(guó)ICL行業(yè)快速發(fā)展,同時(shí)也推動(dòng)了質(zhì)譜和NGS特檢平臺(tái)的快速發(fā)展,。 LDT的特性決定了工業(yè)企業(yè)暫時(shí)無(wú)法大規(guī)模生產(chǎn),。目前國(guó)內(nèi)已有部分公立醫(yī)院實(shí)驗(yàn)室、獨(dú)立醫(yī)學(xué)實(shí)驗(yàn)室(ICL)在遺傳病診斷、腫瘤診斷,、藥物遺傳學(xué)診斷等領(lǐng)域開展LDT項(xiàng)目,。公立醫(yī)院面臨著患者有需求,但沒(méi)有足夠的樣本實(shí)現(xiàn)規(guī)?;?,也無(wú)法通過(guò)大樣本印證LDT方法學(xué)的科學(xué)性的困境。而迪安診斷,、金域醫(yī)學(xué)等內(nèi)資ICL經(jīng)歷了一輪較快的擴(kuò)張階段,,迪安診斷從2010年的8個(gè)實(shí)驗(yàn)室擴(kuò)張至2017年38個(gè);金域醫(yī)學(xué)從2010年14個(gè)增加至2017年37個(gè),。在初步經(jīng)歷了一段較快的擴(kuò)張時(shí)期,,沉淀了一定的高端設(shè)備和高級(jí)專業(yè)技術(shù)人員后,ICL在承擔(dān)LDT項(xiàng)目方面有天然的優(yōu)勢(shì),,或許在短期內(nèi)可通過(guò)和公立醫(yī)院合作實(shí)現(xiàn)共贏,。 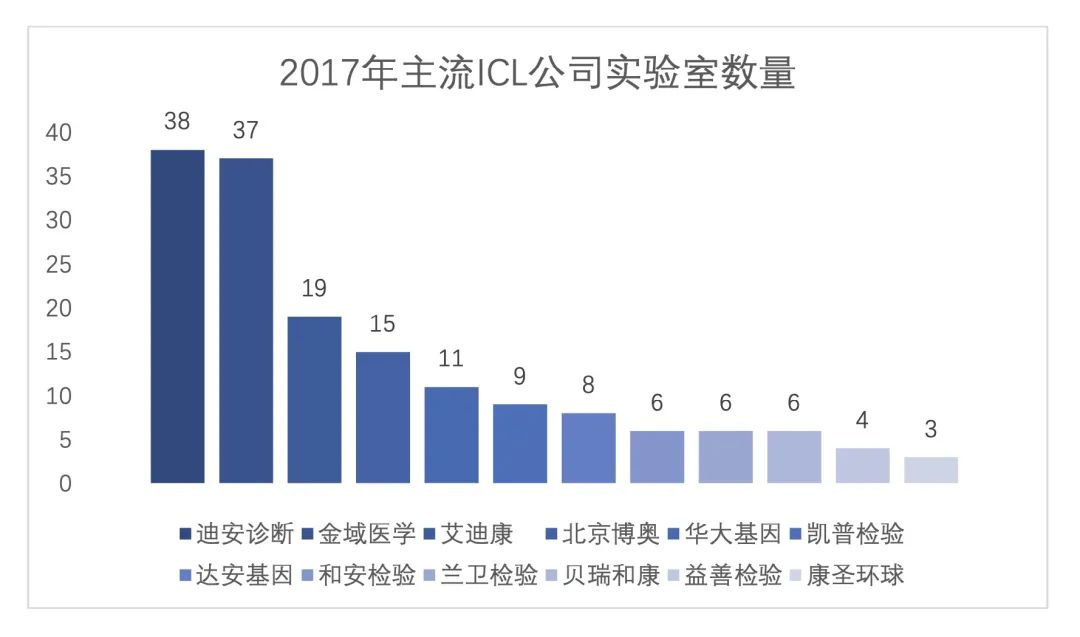 政策的開放,不僅給ICL行業(yè)帶來(lái)新的發(fā)展動(dòng)力,,或許也將進(jìn)一步推動(dòng)我國(guó)特診領(lǐng)域技術(shù)的發(fā)展,,尤其是對(duì)研發(fā)時(shí)長(zhǎng)較長(zhǎng)的分子診斷產(chǎn)品,LDT項(xiàng)目縮短產(chǎn)品在院內(nèi)使用所需等待的時(shí)間,,或?qū)⒓ぐl(fā)工業(yè)企業(yè)的研發(fā)熱情,,同時(shí),分子診斷產(chǎn)品涵蓋腫瘤伴隨診斷和早篩,,我國(guó)的腫瘤患者也將獲益,。
政策的開放,不僅給ICL行業(yè)帶來(lái)新的發(fā)展動(dòng)力,,或許也將進(jìn)一步推動(dòng)我國(guó)特診領(lǐng)域技術(shù)的發(fā)展,,尤其是對(duì)研發(fā)時(shí)長(zhǎng)較長(zhǎng)的分子診斷產(chǎn)品,LDT項(xiàng)目縮短產(chǎn)品在院內(nèi)使用所需等待的時(shí)間,,或?qū)⒓ぐl(fā)工業(yè)企業(yè)的研發(fā)熱情,,同時(shí),分子診斷產(chǎn)品涵蓋腫瘤伴隨診斷和早篩,,我國(guó)的腫瘤患者也將獲益,。
 02什么是IVD,?IVD有哪些? 按照中國(guó)醫(yī)療器械研究院的劃分標(biāo)準(zhǔn),,醫(yī)療器械可以主要分為:高值醫(yī)用耗材,、低值醫(yī)用耗材、醫(yī)療設(shè)備,、IVD(體外診斷),。體外診斷(IVD)則是指通過(guò)對(duì)體外的人體樣本進(jìn)行檢驗(yàn)分析而獲取臨床診斷信息的一種診斷方法。體外檢驗(yàn)的人體樣本包括血液,、體液,、細(xì)胞以及組織等,其應(yīng)用領(lǐng)域包括常規(guī)生化項(xiàng)目的檢驗(yàn),、疾病檢測(cè)以及基因測(cè)序等,。體外診斷試劑是臨床診斷中不可或缺的要素,可為醫(yī)生和患者提供重要的診斷信息,。 按照檢測(cè)原理和應(yīng)用領(lǐng)域,,體外診斷可以分為生化診斷、免疫診斷,、分子診斷,、POCT四種。
02什么是IVD,?IVD有哪些? 按照中國(guó)醫(yī)療器械研究院的劃分標(biāo)準(zhǔn),,醫(yī)療器械可以主要分為:高值醫(yī)用耗材,、低值醫(yī)用耗材、醫(yī)療設(shè)備,、IVD(體外診斷),。體外診斷(IVD)則是指通過(guò)對(duì)體外的人體樣本進(jìn)行檢驗(yàn)分析而獲取臨床診斷信息的一種診斷方法。體外檢驗(yàn)的人體樣本包括血液,、體液,、細(xì)胞以及組織等,其應(yīng)用領(lǐng)域包括常規(guī)生化項(xiàng)目的檢驗(yàn),、疾病檢測(cè)以及基因測(cè)序等,。體外診斷試劑是臨床診斷中不可或缺的要素,可為醫(yī)生和患者提供重要的診斷信息,。 按照檢測(cè)原理和應(yīng)用領(lǐng)域,,體外診斷可以分為生化診斷、免疫診斷,、分子診斷,、POCT四種。  隨著IVD試劑產(chǎn)品種類不斷豐富,,技術(shù)水平不斷提高,,IVD試劑的應(yīng)用場(chǎng)景也不斷豐富,從傳統(tǒng)的醫(yī)院檢驗(yàn)科逐漸向第三方醫(yī)學(xué)診斷機(jī)構(gòu),、體檢中心和基層衛(wèi)生醫(yī)療機(jī)構(gòu)擴(kuò)張,。第三方醫(yī)學(xué)診斷機(jī)構(gòu)又稱為獨(dú)立醫(yī)學(xué)實(shí)驗(yàn)室(Independent Clinical Laboratory,ICL),,是指在衛(wèi)生行政部門的許可下,,具有獨(dú)立法人資格、獨(dú)立于醫(yī)院之外從事臨床檢驗(yàn)或病理診斷和服務(wù)并能獨(dú)立承擔(dān)責(zé)任的醫(yī)療機(jī)構(gòu),。 03,、本次條例修訂對(duì)IVD有什么影響? 2021版新《條例》第53條中明確規(guī)定,,對(duì)國(guó)內(nèi)尚無(wú)同品種產(chǎn)品上市的體外診斷試劑,,符合條件的醫(yī)療機(jī)構(gòu)根據(jù)本單位的臨床需要,可以自行研制,在執(zhí)業(yè)醫(yī)師指導(dǎo)下在本單位內(nèi)使用,。條例中的所說(shuō)的體外診斷試劑,,美國(guó)臨床病理學(xué)會(huì)(ASCP)統(tǒng)稱為實(shí)驗(yàn)室自建項(xiàng)目(Laboratory Developed Test,LDT),。 從監(jiān)管層面來(lái)區(qū)分,,IVD產(chǎn)品主要分為傳統(tǒng)IVD產(chǎn)品和LDT產(chǎn)品,傳統(tǒng)IVD指企業(yè)經(jīng)過(guò)研發(fā),、申報(bào),、上市、生產(chǎn)流程的標(biāo)準(zhǔn)化產(chǎn)品,,需要經(jīng)過(guò)一系列的審批流程,,上市時(shí)間比較長(zhǎng);LDT產(chǎn)品是指實(shí)驗(yàn)室內(nèi)部研發(fā),、檢測(cè)和使用,,以診斷為目的的產(chǎn)品。LDT僅能在研發(fā)的實(shí)驗(yàn)室內(nèi)使用,,可使用購(gòu)買或自制的試劑,但這些試劑不能銷售給其他實(shí)驗(yàn)室,、醫(yī)院或醫(yī)生,。一般是樣本量較小,工業(yè)企業(yè)研發(fā)性價(jià)比較低的產(chǎn)品,。
隨著IVD試劑產(chǎn)品種類不斷豐富,,技術(shù)水平不斷提高,,IVD試劑的應(yīng)用場(chǎng)景也不斷豐富,從傳統(tǒng)的醫(yī)院檢驗(yàn)科逐漸向第三方醫(yī)學(xué)診斷機(jī)構(gòu),、體檢中心和基層衛(wèi)生醫(yī)療機(jī)構(gòu)擴(kuò)張,。第三方醫(yī)學(xué)診斷機(jī)構(gòu)又稱為獨(dú)立醫(yī)學(xué)實(shí)驗(yàn)室(Independent Clinical Laboratory,ICL),,是指在衛(wèi)生行政部門的許可下,,具有獨(dú)立法人資格、獨(dú)立于醫(yī)院之外從事臨床檢驗(yàn)或病理診斷和服務(wù)并能獨(dú)立承擔(dān)責(zé)任的醫(yī)療機(jī)構(gòu),。 03,、本次條例修訂對(duì)IVD有什么影響? 2021版新《條例》第53條中明確規(guī)定,,對(duì)國(guó)內(nèi)尚無(wú)同品種產(chǎn)品上市的體外診斷試劑,,符合條件的醫(yī)療機(jī)構(gòu)根據(jù)本單位的臨床需要,可以自行研制,在執(zhí)業(yè)醫(yī)師指導(dǎo)下在本單位內(nèi)使用,。條例中的所說(shuō)的體外診斷試劑,,美國(guó)臨床病理學(xué)會(huì)(ASCP)統(tǒng)稱為實(shí)驗(yàn)室自建項(xiàng)目(Laboratory Developed Test,LDT),。 從監(jiān)管層面來(lái)區(qū)分,,IVD產(chǎn)品主要分為傳統(tǒng)IVD產(chǎn)品和LDT產(chǎn)品,傳統(tǒng)IVD指企業(yè)經(jīng)過(guò)研發(fā),、申報(bào),、上市、生產(chǎn)流程的標(biāo)準(zhǔn)化產(chǎn)品,,需要經(jīng)過(guò)一系列的審批流程,,上市時(shí)間比較長(zhǎng);LDT產(chǎn)品是指實(shí)驗(yàn)室內(nèi)部研發(fā),、檢測(cè)和使用,,以診斷為目的的產(chǎn)品。LDT僅能在研發(fā)的實(shí)驗(yàn)室內(nèi)使用,,可使用購(gòu)買或自制的試劑,但這些試劑不能銷售給其他實(shí)驗(yàn)室,、醫(yī)院或醫(yī)生,。一般是樣本量較小,工業(yè)企業(yè)研發(fā)性價(jià)比較低的產(chǎn)品,。  LDT是很多特殊檢驗(yàn)的搖籃,,對(duì)新領(lǐng)域、新技術(shù)檢測(cè)的發(fā)展有重大推進(jìn)作用,。近年來(lái),,隨著分子診斷和質(zhì)譜分析等新興技術(shù)的出現(xiàn)和迅猛發(fā)展,LDT已經(jīng)在國(guó)外個(gè)體化醫(yī)療和精準(zhǔn)化醫(yī)療中發(fā)揮出越來(lái)越大的作用,。此次修訂新《條例》,,是我國(guó)首次明確了LDT的合法地位。 放眼全球,,美國(guó)國(guó)會(huì)早已于1967年頒布第一部實(shí)驗(yàn)室管理法案《臨床試驗(yàn)改進(jìn)法案》(67版CLIA),,承認(rèn)了LDT原型的合法性。1990年至2015年,,F(xiàn)DA不斷完善和加強(qiáng)相關(guān)法規(guī)的建設(shè),,在此期間美國(guó)ICL行業(yè)快速發(fā)展,同時(shí)也推動(dòng)了質(zhì)譜和NGS特檢平臺(tái)的快速發(fā)展,。 LDT的特性決定了工業(yè)企業(yè)暫時(shí)無(wú)法大規(guī)模生產(chǎn),。目前國(guó)內(nèi)已有部分公立醫(yī)院實(shí)驗(yàn)室、獨(dú)立醫(yī)學(xué)實(shí)驗(yàn)室(ICL)在遺傳病診斷、腫瘤診斷,、藥物遺傳學(xué)診斷等領(lǐng)域開展LDT項(xiàng)目,。公立醫(yī)院面臨著患者有需求,但沒(méi)有足夠的樣本實(shí)現(xiàn)規(guī)?;?,也無(wú)法通過(guò)大樣本印證LDT方法學(xué)的科學(xué)性的困境。而迪安診斷,、金域醫(yī)學(xué)等內(nèi)資ICL經(jīng)歷了一輪較快的擴(kuò)張階段,,迪安診斷從2010年的8個(gè)實(shí)驗(yàn)室擴(kuò)張至2017年38個(gè);金域醫(yī)學(xué)從2010年14個(gè)增加至2017年37個(gè),。在初步經(jīng)歷了一段較快的擴(kuò)張時(shí)期,,沉淀了一定的高端設(shè)備和高級(jí)專業(yè)技術(shù)人員后,ICL在承擔(dān)LDT項(xiàng)目方面有天然的優(yōu)勢(shì),,或許在短期內(nèi)可通過(guò)和公立醫(yī)院合作實(shí)現(xiàn)共贏,。
LDT是很多特殊檢驗(yàn)的搖籃,,對(duì)新領(lǐng)域、新技術(shù)檢測(cè)的發(fā)展有重大推進(jìn)作用,。近年來(lái),,隨著分子診斷和質(zhì)譜分析等新興技術(shù)的出現(xiàn)和迅猛發(fā)展,LDT已經(jīng)在國(guó)外個(gè)體化醫(yī)療和精準(zhǔn)化醫(yī)療中發(fā)揮出越來(lái)越大的作用,。此次修訂新《條例》,,是我國(guó)首次明確了LDT的合法地位。 放眼全球,,美國(guó)國(guó)會(huì)早已于1967年頒布第一部實(shí)驗(yàn)室管理法案《臨床試驗(yàn)改進(jìn)法案》(67版CLIA),,承認(rèn)了LDT原型的合法性。1990年至2015年,,F(xiàn)DA不斷完善和加強(qiáng)相關(guān)法規(guī)的建設(shè),,在此期間美國(guó)ICL行業(yè)快速發(fā)展,同時(shí)也推動(dòng)了質(zhì)譜和NGS特檢平臺(tái)的快速發(fā)展,。 LDT的特性決定了工業(yè)企業(yè)暫時(shí)無(wú)法大規(guī)模生產(chǎn),。目前國(guó)內(nèi)已有部分公立醫(yī)院實(shí)驗(yàn)室、獨(dú)立醫(yī)學(xué)實(shí)驗(yàn)室(ICL)在遺傳病診斷、腫瘤診斷,、藥物遺傳學(xué)診斷等領(lǐng)域開展LDT項(xiàng)目,。公立醫(yī)院面臨著患者有需求,但沒(méi)有足夠的樣本實(shí)現(xiàn)規(guī)?;?,也無(wú)法通過(guò)大樣本印證LDT方法學(xué)的科學(xué)性的困境。而迪安診斷,、金域醫(yī)學(xué)等內(nèi)資ICL經(jīng)歷了一輪較快的擴(kuò)張階段,,迪安診斷從2010年的8個(gè)實(shí)驗(yàn)室擴(kuò)張至2017年38個(gè);金域醫(yī)學(xué)從2010年14個(gè)增加至2017年37個(gè),。在初步經(jīng)歷了一段較快的擴(kuò)張時(shí)期,,沉淀了一定的高端設(shè)備和高級(jí)專業(yè)技術(shù)人員后,ICL在承擔(dān)LDT項(xiàng)目方面有天然的優(yōu)勢(shì),,或許在短期內(nèi)可通過(guò)和公立醫(yī)院合作實(shí)現(xiàn)共贏,。  政策的開放,不僅給ICL行業(yè)帶來(lái)新的發(fā)展動(dòng)力,,或許也將進(jìn)一步推動(dòng)我國(guó)特診領(lǐng)域技術(shù)的發(fā)展,,尤其是對(duì)研發(fā)時(shí)長(zhǎng)較長(zhǎng)的分子診斷產(chǎn)品,LDT項(xiàng)目縮短產(chǎn)品在院內(nèi)使用所需等待的時(shí)間,,或?qū)⒓ぐl(fā)工業(yè)企業(yè)的研發(fā)熱情,,同時(shí),分子診斷產(chǎn)品涵蓋腫瘤伴隨診斷和早篩,,我國(guó)的腫瘤患者也將獲益,。
政策的開放,不僅給ICL行業(yè)帶來(lái)新的發(fā)展動(dòng)力,,或許也將進(jìn)一步推動(dòng)我國(guó)特診領(lǐng)域技術(shù)的發(fā)展,,尤其是對(duì)研發(fā)時(shí)長(zhǎng)較長(zhǎng)的分子診斷產(chǎn)品,LDT項(xiàng)目縮短產(chǎn)品在院內(nèi)使用所需等待的時(shí)間,,或?qū)⒓ぐl(fā)工業(yè)企業(yè)的研發(fā)熱情,,同時(shí),分子診斷產(chǎn)品涵蓋腫瘤伴隨診斷和早篩,,我國(guó)的腫瘤患者也將獲益,。



