2月25日,國(guó)家藥監(jiān)局發(fā)布通知,,批準(zhǔn)復(fù)宏漢霖研發(fā)的利妥昔單抗注射液(HLX-01)上市申請(qǐng),,該產(chǎn)品成為我國(guó)首個(gè)獲批的生物類似藥。復(fù)宏漢霖聯(lián)合創(chuàng)始人,、總裁兼首席執(zhí)行官劉世高曾經(jīng)對(duì)媒體表示,,在一品雙規(guī)條件下,首個(gè)上市的產(chǎn)品有可能占據(jù)一半的市場(chǎng),。
利妥昔單抗是全球首個(gè)治療非霍奇金淋巴瘤的單抗,,據(jù)米內(nèi)網(wǎng)數(shù)據(jù),2017年該產(chǎn)品全球銷售額為73.88億瑞士法郎,,在全球藥品銷售額排行榜中排位第五,,在生物類似藥的沖擊下,其在2018年的全球銷售額大幅下降,;反觀國(guó)內(nèi)市場(chǎng),,羅氏的美羅華自獲批進(jìn)口后銷售額逐年看漲,2017年順利進(jìn)入醫(yī)保后放量可期,。由于生物類似藥研發(fā)壁壘高,,羅氏多年來獨(dú)占市場(chǎng),隨著復(fù)星醫(yī)藥產(chǎn)品獲批上市,,其余15家企業(yè)的產(chǎn)品步入賽道,,利妥昔單抗國(guó)內(nèi)市場(chǎng)格局或?qū)⒏淖儭?/p>
利妥昔單抗,全球首個(gè)治療非霍奇金淋巴瘤的單抗
利妥昔單抗是一種重組人鼠嵌合抗CD20單克隆抗體靶向藥物,,是全球首個(gè)被批準(zhǔn)用于臨床治療非霍奇金淋巴瘤(NHL)的單克隆抗體,。1997年11月26日,,由羅氏及百健聯(lián)合研發(fā)的利妥昔單抗注射液(英文名Rituximab,商品名Rituxan)獲得FDA批準(zhǔn)上市,,1998年6月2日,,該產(chǎn)品獲得歐洲藥品管理局(EMA)批準(zhǔn)上市,商品名為MabThera,;2000年3月15日,,該產(chǎn)品獲得國(guó)家藥監(jiān)局批準(zhǔn)上市,商品名為美羅華,。
相比于傳統(tǒng)的非霍奇金淋巴瘤治療方法,,利妥昔單抗能特異性地針對(duì)B細(xì)胞,提高患者總生存率,,還能避免損傷身體中的健康組織,,毒副作用較小,因此成為治療非霍奇金淋巴瘤不可或缺的藥物,。臨床結(jié)果顯示,,利妥昔單抗聯(lián)合CHOP化療(環(huán)磷酰胺+阿霉素+長(zhǎng)春新堿+潑尼松)可顯著提升客觀緩解率(ORR)至83%、完全緩解率(CR)至76%,,7年總生存率至53%(化療為36%),,中高危病人提高至42%(化療為28%)。
圖1:2013-2017年羅氏利妥昔單抗注射液全球銷售情況(單位:百萬瑞士法郎)
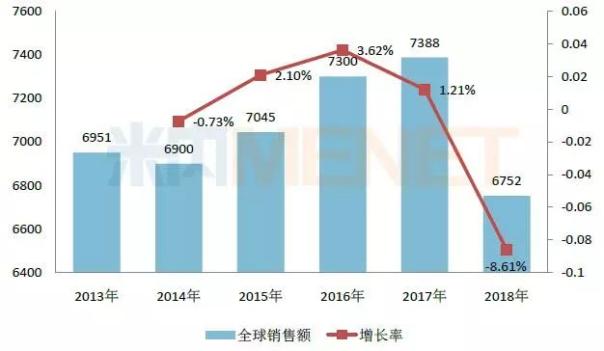
(來源:米內(nèi)網(wǎng)跨國(guó)公司業(yè)績(jī)庫(kù))
作為羅氏單抗三大巨頭之一,,利妥昔單抗連續(xù)多年躋身全球暢銷藥品排行榜TOP10,,雖然該產(chǎn)品在歐洲專利保護(hù)期已于2014年底到期,面臨著生物類似藥的沖擊,,但2015-2017年其全球銷售額仍呈現(xiàn)穩(wěn)步上升的態(tài)勢(shì),,2017年實(shí)現(xiàn)全球銷售額73.88億瑞士法郎,同比去年增長(zhǎng)1.21%,,在2017年全球暢銷藥品排行榜中排位第五,。
2019年2月1日,羅氏公布2018年財(cái)報(bào),,集團(tuán)全年實(shí)現(xiàn)收入568.46億瑞士法郎,,同比去年增長(zhǎng)7%,其中制藥業(yè)務(wù)收入439.67億瑞士法郎,,占集團(tuán)總收入77.34%,。隨著利妥昔單抗在各國(guó)的專利陸續(xù)到期,越來越多的生物類似藥獲批上市造成沖擊,,2018年羅氏的利妥昔單抗全球銷售額僅為67.52億瑞士法郎,,同比去年下滑8.61%,其中在歐洲市場(chǎng)收入同比去年下滑47%,。
圖2:2013-2017年中國(guó)公立醫(yī)療機(jī)構(gòu)終端利妥昔單抗注射液銷售情況(單位:萬元)
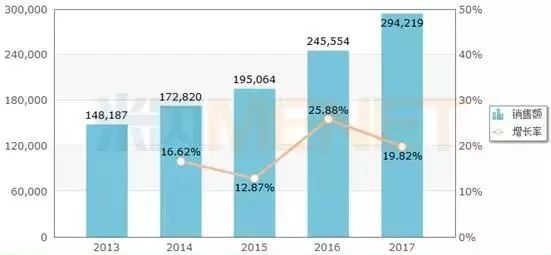
(來源:米內(nèi)網(wǎng)中國(guó)公立醫(yī)療機(jī)構(gòu)終端競(jìng)爭(zhēng)格局)
羅氏的利妥昔單抗于2000年獲得國(guó)家藥監(jiān)局批準(zhǔn)進(jìn)入中國(guó)市場(chǎng),,商品名為美羅華,。近幾年來,美羅華在中國(guó)公立醫(yī)療機(jī)構(gòu)終端的銷售額一直保持兩位數(shù)的增長(zhǎng)率穩(wěn)步增長(zhǎng),,2017年實(shí)現(xiàn)銷售額29.42億元,,同比去年增長(zhǎng)19.82%。
表1:2016-2018年羅氏利妥昔單抗注射液中標(biāo)情況(單位:元/瓶)
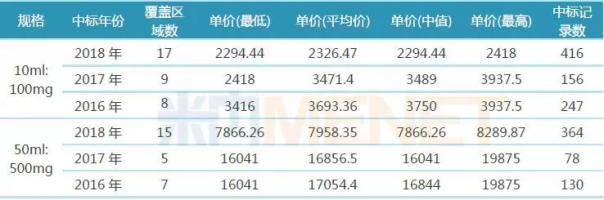
(來源:米內(nèi)網(wǎng)中國(guó)藥品招投標(biāo)數(shù)據(jù)庫(kù))
2017年7月,,羅氏的利妥昔單抗通過醫(yī)保談判進(jìn)入2017年版國(guó)家醫(yī)保目錄,,10ml:100mg、50ml:500mg規(guī)格的美羅華醫(yī)保支付標(biāo)準(zhǔn)分別為2418元/瓶,、8289.87元/瓶,,據(jù)米內(nèi)網(wǎng)中國(guó)藥品招投標(biāo)數(shù)據(jù)庫(kù),2017年10ml:100mg,、50ml:500mg規(guī)格的美羅華平均中標(biāo)價(jià)分別為3471.4元/瓶,,16856.5元/瓶;2018年,,各省開展抗癌藥專項(xiàng)集中采購(gòu),美羅華價(jià)格進(jìn)一步降低,,據(jù)米內(nèi)網(wǎng)中國(guó)藥品招投標(biāo)數(shù)據(jù)庫(kù),,2018年10ml:100mg、50ml:500mg規(guī)格的美羅華平均中標(biāo)價(jià)分別為2326.47元/瓶,,7958.35元/瓶,。
美羅華順利降價(jià)進(jìn)入醫(yī)保,有望實(shí)現(xiàn)迅速放量,,利妥昔單抗注射液在國(guó)內(nèi)的市場(chǎng)將進(jìn)一步擴(kuò)大,。由于生物類似藥在工藝制備、上市審批和臨床使用上具有較高的技術(shù)壁壘,,近十年間利妥昔單抗國(guó)內(nèi)市場(chǎng)由羅氏獨(dú)占,,如今隨著復(fù)星醫(yī)藥的生物類似藥獲批上市,2019年該產(chǎn)品在國(guó)內(nèi)的市場(chǎng)格局或?qū)⒅貥?gòu),。
復(fù)宏漢霖聯(lián)合創(chuàng)始人,、總裁兼首席執(zhí)行官劉世高曾經(jīng)對(duì)媒體表示:從醫(yī)院準(zhǔn)入、銷售布局來看,,第一個(gè)上市的產(chǎn)品有巨大優(yōu)勢(shì),,按照過去的案例來看,很有可能占據(jù)一半以上的市場(chǎng),,很多醫(yī)院實(shí)行“一品雙規(guī)”,,即一個(gè)產(chǎn)品只有原研藥、和第一個(gè)進(jìn)入市場(chǎng)的生物類似藥兩種,,所以第二個(gè)進(jìn)入市場(chǎng)的生物類似藥開拓市場(chǎng)的難度就會(huì)大幅上升,。
復(fù)星斬獲我國(guó)首個(gè)生物類似藥,,定價(jià)如何?
2月25日,,國(guó)家藥監(jiān)局發(fā)布通知,,批準(zhǔn)復(fù)宏漢霖研發(fā)的利妥昔單抗注射液(HLX-01)上市申請(qǐng)。截至2019年1月,,公司針對(duì)該產(chǎn)品(包括非霍奇金淋巴瘤適應(yīng)癥及類風(fēng)濕關(guān)節(jié)炎適應(yīng)癥)已投入研發(fā)費(fèi)用約4.54億元,。
2007年,新版《藥品注冊(cè)管理辦法》完成修訂正式頒布,,包括生物類似藥在內(nèi)的所有生物制品均按照新藥上市流程進(jìn)行申報(bào),;2015年,《生物類似藥研發(fā)與評(píng)價(jià)技術(shù)指導(dǎo)原則(試行)》及《藥品注冊(cè)管理辦法(修訂稿)》相繼出臺(tái),,國(guó)內(nèi)對(duì)生物類似藥的監(jiān)管逐步與國(guó)際接軌,。按照國(guó)際標(biāo)準(zhǔn),復(fù)星醫(yī)藥的利妥昔單抗注射液是我國(guó)首個(gè)獲批上市的生物類似藥,。
圖3:復(fù)宏漢霖利妥昔單抗審評(píng)時(shí)間軸
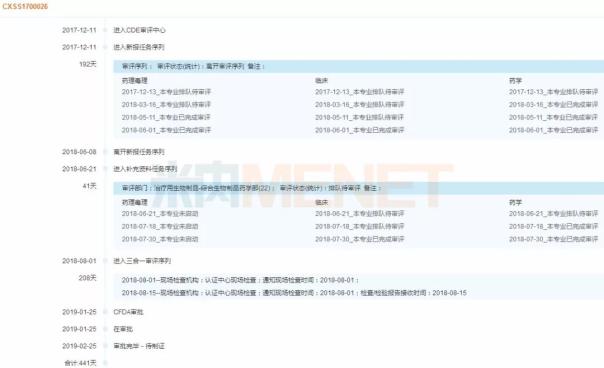
(來源:米內(nèi)網(wǎng)MED藥品審評(píng)數(shù)據(jù)庫(kù)2.0)
據(jù)米內(nèi)網(wǎng)MED藥品審評(píng)數(shù)據(jù)庫(kù)2.0,,復(fù)宏漢霖于2017年10月提交了利妥昔單抗注射液的上市申請(qǐng),適應(yīng)癥為非霍奇金淋巴瘤,;同年12月11日,,該產(chǎn)品的上市申請(qǐng)獲得CDE承辦受理,受理號(hào)CXSS1700026,;2018年1月29日,,該產(chǎn)品以“重大專項(xiàng)”為由納入優(yōu)先審評(píng)。2019年1月,,該產(chǎn)品審評(píng)完畢,,同年2月審批完畢,目前已獲批生產(chǎn),。
利妥昔單抗是復(fù)星醫(yī)藥開發(fā)的第一個(gè)生物藥,,據(jù)公司披露的III期臨床數(shù)據(jù),該產(chǎn)品與原研藥(美羅華)在治療CD20陽性彌漫型大B非霍奇金淋巴瘤(DLBCL)初治患者的臨床試驗(yàn)主要終點(diǎn),、次要終點(diǎn)(安全性,、免疫原性、藥代動(dòng)力學(xué))均達(dá)到預(yù)設(shè)標(biāo)準(zhǔn),。
據(jù)悉,,羅氏的利妥昔單抗在歐洲的專利保護(hù)已于2014年底到期,在美國(guó)的專利于2018年下半年到期,。2018年3月,,我國(guó)專利復(fù)審委作出第35201號(hào)無效宣告審查決定,宣告百健第200510062686.8號(hào)"包括施用抗-CD20抗體的B-細(xì)胞淋巴瘤聯(lián)合療法"發(fā)明專利(第686號(hào)專利)全部無效,,這意味著復(fù)星醫(yī)藥的利妥昔單抗生物類似藥上市銷售已無專利障礙,。
雖然美羅華通過談判降價(jià)進(jìn)入醫(yī)保,,但其費(fèi)用對(duì)患者來說仍舊具有一定負(fù)擔(dān),復(fù)星的生物類似藥上市后能否迅速覆蓋有實(shí)際用藥需求但是不能負(fù)擔(dān)藥價(jià)的患者,,這有賴于其產(chǎn)品的定價(jià),,從市場(chǎng)角度來看,生物類似藥降價(jià)幅度普遍為原研的10%~35%,,復(fù)星會(huì)如何定價(jià),?我們拭目以待。
16家國(guó)內(nèi)企業(yè)布局,,美羅華類似物研發(fā)競(jìng)爭(zhēng)激烈
據(jù)米內(nèi)網(wǎng)全球藥物研發(fā)庫(kù),,目前全球已有多個(gè)利妥昔單抗生物類似藥獲批上市,包括印度intas制藥,、瑞迪博士實(shí)驗(yàn)室,、諾華等企業(yè)的產(chǎn)品。此外,,羅氏后續(xù)研發(fā)的第二代人源化抗CD20抗體奧比妥珠單抗(英文名Obinutuzumab,,商品名Gazyva)和奧瑞利珠單抗(英文名ocrelizumab,商品名Ocrevus)也分別于2013年,、2017年獲得FDA批準(zhǔn)上市,。
反觀國(guó)內(nèi)市場(chǎng),目前布局利妥昔單抗生物類似藥開發(fā)的制藥企業(yè)超過十家,,包括信達(dá)生物、海正藥業(yè),、正大天晴,、麗珠單抗等知名企業(yè),競(jìng)爭(zhēng)非常激烈,。
表2:利妥昔單抗生物類似藥國(guó)內(nèi)研發(fā)進(jìn)展
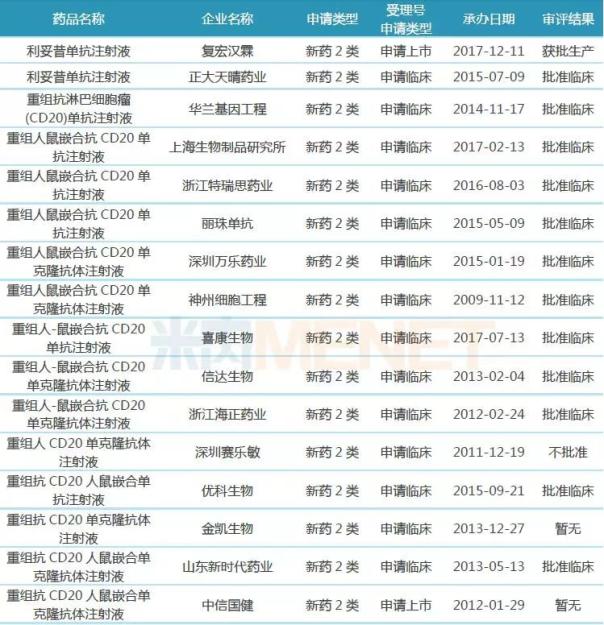
(來源:米內(nèi)網(wǎng)MED藥品審評(píng)數(shù)據(jù)庫(kù)2.0)
從研發(fā)進(jìn)展看,,中信國(guó)健的重組抗CD20人鼠嵌合單克隆抗體注射液最早提出上市申請(qǐng),但由于臨床數(shù)據(jù)規(guī)范性問題而撤回,;復(fù)宏漢霖的利妥昔單抗注射液的上市申請(qǐng)于2017年12月獲得CDE承辦受理,,目前已獲批生產(chǎn),此外,,該產(chǎn)品針對(duì)類風(fēng)濕性關(guān)節(jié)炎的適應(yīng)癥處于臨床III期階段,。
研發(fā)進(jìn)展比較靠前的還有信達(dá)生物、神州細(xì)胞工程,、浙江海正藥業(yè),、正大天晴藥業(yè)、優(yōu)科生物,、喜康生物等企業(yè),,其相應(yīng)的產(chǎn)品均已進(jìn)入臨床III期,。
來源:米內(nèi)網(wǎng)數(shù)據(jù)庫(kù)、上市公司公告,、中泰證券研究所等







