最新消息顯示,,上海復(fù)宏漢霖利妥昔單抗注射液的上市申請(qǐng)已審評(píng)完畢,目前處于審批階段,,如無意外,,將在不久后獲批。其也將成為首個(gè)與國(guó)際標(biāo)準(zhǔn)接軌的國(guó)產(chǎn)生物類似藥,。
近年來,,全球生物類似藥開發(fā)主要集中在一系列專利已經(jīng)或即將到期的生物制劑,包括阿達(dá)木單抗,、英夫利昔單抗、利妥昔單抗,、貝伐珠單抗,、曲妥珠單抗等。單抗藥物在全球市場(chǎng)發(fā)展迅速,,國(guó)內(nèi)藥企也紛紛布局,,競(jìng)相角逐這個(gè)快速增長(zhǎng)的領(lǐng)域,中國(guó)生物類似藥迎來了蓬勃發(fā)展的好時(shí)代,。
國(guó)產(chǎn)生物類似藥發(fā)展趨勢(shì)大好,,下面重點(diǎn)介紹國(guó)內(nèi)幾種處于提交上市申請(qǐng)階段的重磅單抗品種。
現(xiàn)狀
政策利好
近年來,,我國(guó)制定和頒布了多項(xiàng)生物類似藥相關(guān)政策,,希望借助生物類似藥來打破單抗類似藥長(zhǎng)期依賴進(jìn)口的現(xiàn)狀。2014年12月,,國(guó)家藥監(jiān)局頒布了《生物類似藥研發(fā)與技術(shù)指導(dǎo)原則(征求意見稿)》,;2015年2月,頒布了《生物類似藥研發(fā)與技術(shù)指導(dǎo)原則(試行)》;2016年7月,,《藥品注冊(cè)管理辦法(修訂稿)》進(jìn)一步規(guī)范生物類似藥的概念和審批標(biāo)準(zhǔn),;2017年10 月,兩辦聯(lián)合發(fā)布的《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見》再一次明確提出支持生物類似藥發(fā)展,。
這些政策的陸續(xù)出臺(tái),,對(duì)于我國(guó)生物類似藥的開發(fā)具有極其重要的指導(dǎo)意義,同時(shí)也標(biāo)志著我國(guó)生物類似藥審批政策已經(jīng)逐漸與國(guó)際接軌,。
百花齊放
目前國(guó)內(nèi)已有多家藥企的生物類似藥處于提交上市申請(qǐng)階段,,主要有復(fù)宏漢霖的利妥昔單抗類似藥HLX01、齊魯制藥的貝伐珠單抗類似藥QL1101,、三生國(guó)健的曲妥珠單抗類似藥注射用重組抗HER2人源化單克隆抗體(302H),、百邁博的英夫利昔單抗類似藥CMAB-008等。此外,,阿達(dá)木單抗類似藥處于上市申請(qǐng)階段的有百奧泰的BAT1406,、海正藥業(yè)的HS016、信達(dá)生物的IBI303以及復(fù)宏漢霖的HLX03,,另有多家企業(yè)的產(chǎn)品已處于Ⅲ期臨床階段,。
重點(diǎn)品種
利妥昔單抗
原研企業(yè):羅氏
國(guó)內(nèi)提交上市申請(qǐng):復(fù)宏漢霖
利妥昔單抗由羅氏開發(fā),商品名為“Rituxan”,,1997年和1998年先后被FDA和EMA批準(zhǔn)上市,,主要適應(yīng)癥為非霍奇金淋巴瘤、慢性淋巴細(xì)胞白血病和類風(fēng)濕關(guān)節(jié)炎,。目前歐盟已批準(zhǔn)兩種利妥昔單抗生物類似藥:Celltrion 公司的Truxima及諾華旗下Sandoz公司的Rixathon/Riximyo,。
全球市場(chǎng)
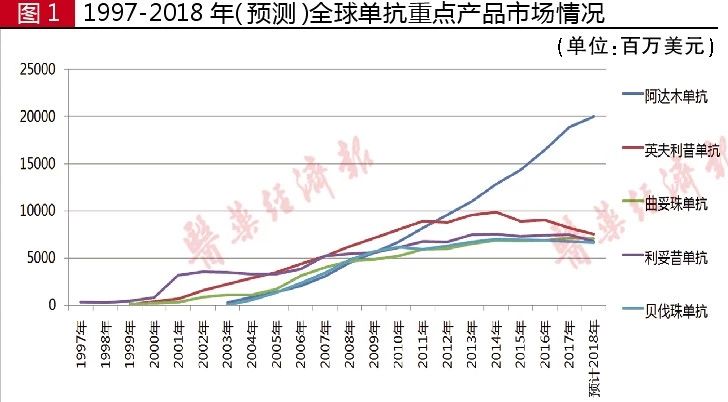
據(jù)全球暢銷藥數(shù)據(jù)統(tǒng)計(jì),1998年利妥昔單抗銷售額為3.2億美元,,2007年銷售額過50億美元,,2017年銷售額達(dá)75億美元,2007-2017年已連續(xù)11年銷售額過50億美元,。
從1998-2017年銷售情況來看,,該產(chǎn)品累計(jì)銷售額高達(dá)958億美元,至今仍是CD20單抗領(lǐng)域的霸主產(chǎn)品,。2018年前三季度,,利妥昔單抗全球銷售額為50.93億美元,預(yù)計(jì)全年銷售額為68億美元,。
國(guó)內(nèi)市場(chǎng)
2000年,,羅氏的利妥昔單抗在我國(guó)進(jìn)口上市,商品名為美羅華,,劑型為注射液,,規(guī)格為100mg/10ml,、500mg/50ml,在中國(guó)批準(zhǔn)非霍奇金淋巴瘤適應(yīng)癥,。
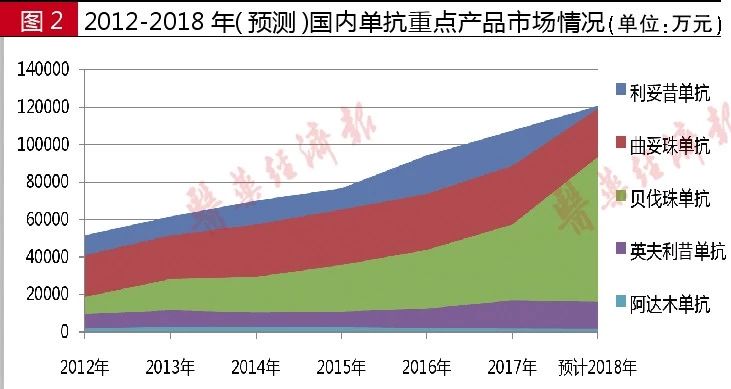
據(jù)國(guó)內(nèi)樣本醫(yī)院數(shù)據(jù)統(tǒng)計(jì),,利妥昔單抗2012年用藥金額為5.16億元,2017年為10.8億元,。2018年前三季度國(guó)內(nèi)樣本醫(yī)院用藥金額為9.1億元,,預(yù)計(jì)2018年用藥金額將超過12.0億元。該產(chǎn)品是羅氏在中國(guó)最暢銷的藥品,,2017年醫(yī)保準(zhǔn)入談判后,,利妥昔單抗降價(jià)幅度高達(dá)58.45%,之后市場(chǎng)迅速放量,。
申報(bào)情況
目前國(guó)內(nèi)利妥昔單抗類似藥申報(bào)企業(yè)已有十幾家,,研發(fā)進(jìn)度最快的是復(fù)宏漢霖,已經(jīng)處于申請(qǐng)上市階段,。另有信達(dá)生物,、神州細(xì)胞工程、喜康生物,、海正藥業(yè)4家公司的產(chǎn)品進(jìn)入臨床Ⅲ期,,中信國(guó)健撤回。
2018年1月,,復(fù)宏漢霖利妥昔單抗注射劑治療非霍奇金淋巴瘤和類風(fēng)濕關(guān)節(jié)炎的上市申請(qǐng)被列入優(yōu)先審評(píng),。
點(diǎn)評(píng)
這是中國(guó)首個(gè)申請(qǐng)上市的生物類似藥,此前也被預(yù)計(jì)將成為第一個(gè)進(jìn)入市場(chǎng)的國(guó)產(chǎn)生物類似藥,,目前獲批在即,。
曲妥珠單抗
原研企業(yè):羅氏
國(guó)內(nèi)提交上市申請(qǐng):三生國(guó)健
曲妥珠單抗由羅氏公司生產(chǎn),商品名為“Hercepti”,,1998年經(jīng)過FDA批準(zhǔn),,此后分別于2000年和2001年在歐洲和日本獲批。
目前,,全球只有兩種曲妥珠單抗生物類似藥上市,分別是:FDA批準(zhǔn)Mylan/Biocon開發(fā)的Ogivri及EMA批準(zhǔn)三星生物的Ontruzant,。
全球市場(chǎng)
據(jù)全球暢銷藥數(shù)據(jù)統(tǒng)計(jì),,1999年曲妥珠單抗銷售額為1.88億美元,2003年銷售額過10億美元,,2006年銷售額過30億美元,,2010年銷售額過50億美元, 2017年銷售額71.27億美元,。1997-2017年,,該產(chǎn)品累計(jì)銷售額高達(dá)705億美元,。2018年前三季度,曲妥珠單抗全球銷售額為52.89億美元,,預(yù)計(jì)全年銷售額為71億美元,。
國(guó)內(nèi)市場(chǎng)
2002年9月,羅氏的曲妥珠單抗獲批進(jìn)入中國(guó),,商品名為赫賽汀,,在國(guó)內(nèi)獲批治療HER2陽性乳腺癌、HER2陽性胃癌,,劑型為粉針劑,,規(guī)格為440mg、150mg,。
據(jù)國(guó)內(nèi)樣本醫(yī)院數(shù)據(jù)統(tǒng)計(jì),,曲妥珠單抗2012年用藥金額為4.10億元,2016年用藥金額為7.37億元,,2017年用藥金額為8.87億元,,較同期增長(zhǎng)20.4%。2018年前三季度,,曲妥珠單抗整體市場(chǎng)為8.9億元,,預(yù)計(jì)2018年用藥金額超過12.0億元。2017年曲妥珠單抗通過價(jià)格談判進(jìn)入醫(yī)保目錄,,降價(jià)幅度達(dá) 65%,。2018年版基藥數(shù)量擴(kuò)容,曲妥珠單抗進(jìn)入其中,。
申報(bào)情況
目前國(guó)內(nèi)申報(bào)曲妥珠單抗類似藥的企業(yè)有10多家,,研發(fā)進(jìn)度最快的三生國(guó)健,已提交上市申請(qǐng),,商品名為賽普汀,。另有嘉和生物、正大天晴,、復(fù)宏漢霖,、安科生物和海正藥業(yè)5家企業(yè)的產(chǎn)品進(jìn)入Ⅲ期臨床。
點(diǎn)評(píng)
三生國(guó)健的曲妥珠單抗生物類似藥有望首個(gè)獲批,,隨著醫(yī)保范圍的不斷擴(kuò)容,,未來市場(chǎng)規(guī)模有望快速增長(zhǎng)。
阿達(dá)木單抗
原研企業(yè):艾伯維
國(guó)內(nèi)提交上市申請(qǐng):百奧泰,、海正藥業(yè),、信達(dá)生物、復(fù)宏漢霖
阿達(dá)木單抗由艾伯維研發(fā),,商品名為“Humira”,,2002年12月獲FDA批準(zhǔn),,2003年9月獲EMA批準(zhǔn),2008年4月獲PMDA批準(zhǔn),。獲批適應(yīng)癥主要包括強(qiáng)直性脊柱炎,、克羅恩病、銀屑病,、幼年特發(fā)性關(guān)節(jié)炎,、銀屑病關(guān)節(jié)炎、潰瘍性結(jié)腸炎,、皮膚化膿性汗腺炎,、葡萄膜炎。該藥已在全球90多個(gè)國(guó)家獲批上市,。
目前,,美國(guó)已批準(zhǔn)了三種阿達(dá)木單抗生物類似藥:安進(jìn)的Amjevita、勃林格殷格翰的Cyltezo,、Sandoz的Hyrimoz,。歐盟批準(zhǔn)了4個(gè):Amgevita和Cyltezo以及安進(jìn)的Solymbic和三星生物的Imraldi。
全球市場(chǎng)
據(jù)全球暢銷藥數(shù)據(jù)統(tǒng)計(jì),,2003年阿達(dá)木單抗銷售額為2.8億美元,,2005年過10億美元,2006年過20億美元,,2009年過50億美元,,2013年過100億美元,2016年過150億美元,,2017年銷售額189.08億美元,。2003-2017年該產(chǎn)品累計(jì)銷售額已高達(dá)1159億美元,連續(xù)六年穩(wěn)坐全球“藥王”寶座,。2018年前三季度,,阿達(dá)木單抗全球銷售額為150.18億美元,預(yù)計(jì)全年銷售額超過200億美元,。
國(guó)內(nèi)市場(chǎng)
2009年,,艾伯維的阿達(dá)木單抗在我國(guó)獲批上市,商品名為修美樂,,劑型為注射液,,規(guī)格為140mg/0.8ml 。
據(jù)國(guó)內(nèi)樣本醫(yī)院數(shù)據(jù)統(tǒng)計(jì),,阿達(dá)木單抗2012年用藥金額為1809萬元,2016年為2208萬元,,2017年為1795萬元,,較同期下降11.5%,。2018年前三季度,阿達(dá)木單抗用藥金額為1209萬元,,預(yù)計(jì)2018年用藥金額超過1700萬元,。
對(duì)比全球市場(chǎng),阿達(dá)木單抗目前在中國(guó)的銷售情況并不理想,,隨著更多適應(yīng)癥在國(guó)內(nèi)上市,,市場(chǎng)潛力依然巨大。
申報(bào)情況
當(dāng)前,,國(guó)內(nèi)申報(bào)阿達(dá)木單抗類似藥的企業(yè)已有20多家,,研發(fā)進(jìn)度最快的是百奧泰、海正,、信達(dá)生物和復(fù)宏漢霖,,已經(jīng)處于申請(qǐng)上市階段。另有君實(shí)生物,、正大天晴的產(chǎn)品進(jìn)入臨床Ⅲ期,。
點(diǎn)評(píng)
國(guó)內(nèi)四家企業(yè)爭(zhēng)奪阿達(dá)木單抗生物類似藥首仿資格的爭(zhēng)奪戰(zhàn)越發(fā)激烈。從申報(bào)進(jìn)度來看,,百奧泰快于海正,,海正快于信達(dá),復(fù)宏漢霖是在近日才申報(bào)生產(chǎn),。一旦首個(gè)阿達(dá)木生物類似藥上市,,將會(huì)憑借價(jià)格優(yōu)勢(shì)擁有一席之地。
貝伐珠單抗
原研企業(yè):羅氏
國(guó)內(nèi)提交上市申請(qǐng):齊魯制藥,、信達(dá)生物
貝伐珠單抗由羅氏旗下基因泰克開發(fā),,商品名為“Avastin”。該藥于2004年2月和2005年1月相繼獲得FDA和EMA的批準(zhǔn),。目前已獲得結(jié)直腸癌,、非小細(xì)胞肺癌、膠質(zhì)母細(xì)胞瘤,、腎細(xì)胞癌,、宮頸癌、卵巢癌,、輸卵管癌,、腹膜癌等多個(gè)實(shí)體瘤適應(yīng)癥。
目前,,全球市場(chǎng)上只有一種貝伐珠單抗生物類似藥,,即由安進(jìn)和艾爾建聯(lián)合開發(fā)的Mvasi,已經(jīng)在美國(guó)和歐盟獲批,。
全球市場(chǎng)
據(jù)全球暢銷藥數(shù)據(jù)統(tǒng)計(jì),,2005年貝伐珠單抗銷售額為1.88億美元,,2002年銷售額突破10億美元大關(guān),2006年突破30億美元,,2010年突破50億美元,,此后連續(xù)8年銷售額居于60億~70億美元之間。
該藥1999-2017年累計(jì)銷售額為712億美元,。2018年前三季度,,貝伐珠單抗全球市場(chǎng)銷售額為50.09億美元,預(yù)計(jì)全年銷售額為67億美元,。
貝伐珠單抗的歐洲專利保護(hù)于2018年到期,,美國(guó)專利保護(hù)將于2019年到期,該藥已成為國(guó)內(nèi)外熱門仿制產(chǎn)品,。
國(guó)內(nèi)市場(chǎng)
2010年2月,,羅氏的貝伐珠單抗獲批在我國(guó)上市,商品名為安維汀,,主要用于治療轉(zhuǎn)移性結(jié)直腸癌和晚期,、轉(zhuǎn)移性或復(fù)發(fā)性非小細(xì)胞肺癌。劑型為注射液,,規(guī)格為100mg(4ml),、400mg(16ml)兩種。
據(jù)國(guó)內(nèi)樣本醫(yī)院數(shù)據(jù)統(tǒng)計(jì),,貝伐珠單抗2012年用藥金額為1.86億元,,2013年為2.82億元, 2016年為4.34億元,,2017年為5.73億元,,較同期增長(zhǎng)30.9%。2018年前三季度,,貝伐珠單抗用藥金額為7.0億元,,預(yù)計(jì)2018年將超過9.5億元。
2017年,,貝伐珠單抗通過價(jià)格談判進(jìn)入國(guó)家醫(yī)保目錄,,降價(jià)幅度達(dá)62%,隨著醫(yī)保政策紅利釋放,,市場(chǎng)快速增長(zhǎng),。
申報(bào)情況
目前國(guó)內(nèi)申報(bào)貝伐珠單抗類似藥的企業(yè)已有20多家,研發(fā)進(jìn)度最快的是齊魯制藥,,已經(jīng)處于申請(qǐng)上市階段,。1月29日,信達(dá)生物也宣布其貝伐珠單抗生物類似藥IBI-305上市申請(qǐng)已被受理。另有東曜藥業(yè),、北京天廣實(shí)生物,、正大天晴、恒瑞,、綠葉制藥、百奧泰,、嘉和生物的產(chǎn)品進(jìn)入臨床Ⅲ期,。
點(diǎn)評(píng)
齊魯制藥的重組抗VEGF人源化單克隆抗體注射液作為重大專項(xiàng)品種納入第三十三批優(yōu)先審評(píng)名單。如能拔得頭籌,,將有助于推動(dòng)該企業(yè)腫瘤產(chǎn)品線的快速增長(zhǎng),。
英夫利昔單抗
原研企業(yè):強(qiáng)生
國(guó)內(nèi)提交上市申請(qǐng):百邁博
英夫利昔單抗由美國(guó)強(qiáng)生公司楊森開發(fā),商品名為“Remicade”,,于1998年和1999年8月先后獲FDA和EMA批準(zhǔn),。目前主要獲批用于治療炎癥相關(guān)疾病,包括克羅恩病,、潰瘍性結(jié)腸炎,、類風(fēng)濕性關(guān)節(jié)炎、強(qiáng)直性脊柱炎,、牛皮癬性關(guān)節(jié)炎和斑塊型牛皮癬,。該藥歐洲專利已于2014年到期,美國(guó)專利2018年到期,。
目前,,美國(guó)只有3種英夫利昔單抗生物類似藥獲批,分別是:輝瑞/Celltrion的Inflectra,、輝瑞的Ixifi,、三星的Renflexis。EMA則批準(zhǔn)了3款產(chǎn)品,,輝瑞的Inflectra,、Celltrion的Remsima和三星的Flixabi。
全球市場(chǎng)
據(jù)全球暢銷藥數(shù)據(jù)統(tǒng)計(jì),,1999年英夫利昔單抗銷售額為1.46億美元,,2002年突破15億美元,2003年突破20億美元,,2005年突破30億美元,,2007年突破50億美元,此后連續(xù)10年銷售額居于60億~80億美元之間,,2017年銷售額為82.16億美元,。
國(guó)內(nèi)市場(chǎng)
2007年,強(qiáng)生的英夫利昔單抗在我國(guó)進(jìn)口上市,商品名為類克,,劑型為粉針劑,,規(guī)格為100mg,在中國(guó)獲批銀屑病適應(yīng)癥,。
據(jù)國(guó)內(nèi)樣本醫(yī)院數(shù)據(jù)統(tǒng)計(jì),,英夫利昔單抗2012年銷售額為9561萬元,2016年銷售額為1.24億元,,2017年銷售額為1.68億元,,較同期增長(zhǎng)35.3%。2018年前三季度,,英夫利昔單抗國(guó)內(nèi)樣本醫(yī)院用藥金額為1.2億元,,預(yù)計(jì)2018年用藥金額超過1.6億元。
申報(bào)情況
目前國(guó)內(nèi)申報(bào)英夫利昔單抗生物類似藥的企業(yè)中,,研發(fā)進(jìn)度最快的是百邁博,,已經(jīng)處于申請(qǐng)上市階段。另有海正藥業(yè),、嘉和生物兩家公司的產(chǎn)品進(jìn)入臨床Ⅲ期,。
點(diǎn)評(píng)
該產(chǎn)品未進(jìn)入國(guó)家醫(yī)保目錄且價(jià)格高昂,加上沒有獲批單獨(dú)用于治療類風(fēng)濕性關(guān)節(jié)炎,,臨床使用受到限制,。







