近幾年,,國家醫(yī)藥政策頻出,,尤其是隨著新醫(yī)改政策的不斷推進,兩票制,、藥品零加成,、藥品注冊、一致性評價等各項政策暴風驟雨式落地,,讓行業(yè)面臨新的機遇與挑戰(zhàn),。
其實還有多項政策正在逐步改變中國用藥市場格局,那就是2015年開始推進,、現(xiàn)在逐步結出碩果的優(yōu)先審評審批,、鼓勵創(chuàng)新的相關制度。據(jù)初步不完全統(tǒng)計,,2016年至今獲批的代表性新藥至少有100個,,其中80余個進口品種在全球市場上市的品種市場規(guī)模已接近千億美元,國內市場空間預計也有千億人民幣,。
▍新藥上市大提速
近些年,,大提速的不只有火車,還有新藥批準上市,。
筆者統(tǒng)計整理的100個獲批新藥2016-2018年分別為6個,、43個和50個,可見優(yōu)先審評效果逐步顯現(xiàn),,獲批的新藥大提速,。(具體詳見文章末尾清單)
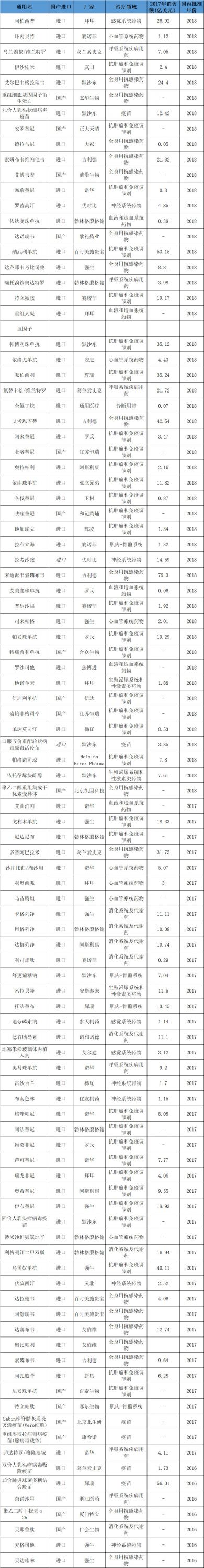
從所統(tǒng)計的100個藥品所屬治療領域來看,以腫瘤藥為主,,多達34個,,全身抗感染(以丙肝、艾滋病用藥為主),、心血管系統(tǒng),、消化系統(tǒng)及代謝藥(以糖尿病為主)也有較多品種。
注:根據(jù)公開資料整理,,供參考,。
從審評審批周期上看,大多新藥以優(yōu)先審評方式獲批,;整個審批周期少于6個月的新藥有3個,,不少藥品審批周期小于2年,。
從獲批新藥屬于國產(chǎn)還是進口來看,近幾年獲批新藥大多還是以進口為主,,進口藥品有83個,,國產(chǎn)的藥品僅有17個,,這些藥品國內市場預計在千億元以上,。
這83個進口藥大多在全球已上市,據(jù)不完全統(tǒng)計,,這些藥品2017年全球合計銷售額已接近900億美元,。
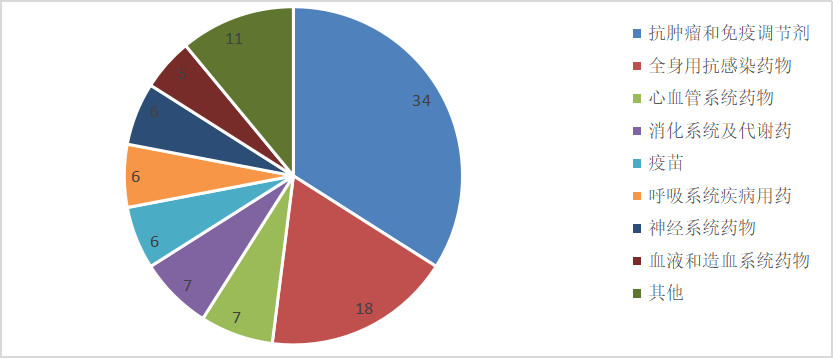
從廠家分布來看,強生,、默沙東,、諾華、勃林格等幾家企業(yè)近幾年在國內獲批的新藥相對較多,,在7個以上,,而國內企業(yè)大多為1-2個。
注:根據(jù)公開資料整理,,供參考,。
這與國家2016年開始加強實施的優(yōu)先審評審批政策密不可分。原國家食品藥品監(jiān)管總局出臺《關于解決藥品注冊申請積壓實行優(yōu)先審評審批的意見》,,將多種情況納入優(yōu)先審評范圍,,其中包括防治艾滋病、肺結核,、病毒性肝炎,、罕見病、惡性腫瘤藥物以及兒童老人急等的“救命藥”的注冊申請,。
從此,,開始有大批藥品通過優(yōu)先審評審批途徑上報并獲批。截至2018年底,,共有30余批770件注冊申請納入優(yōu)先審評程序,。
▍鼓勵創(chuàng)新,新藥逐步與國際市場接軌
*鼓勵創(chuàng)新政策頻發(fā)
自2015年以來,,醫(yī)藥研發(fā)端政策導向,,新藥獲批的時間大大縮短,其中表現(xiàn)明顯的是國外新藥進入國內時間差大幅縮短,。相關政策主要表現(xiàn)為優(yōu)先審評審批+加快進口藥品國內上市+加入ICH+藥品上市許可人+化藥注冊分類變更:優(yōu)勝劣汰,,鼓勵創(chuàng)新,加快審評,,減少注冊積壓,,與國際接軌,。
自2015年開始,國內多個部門發(fā)布了多項鼓勵藥品研發(fā)創(chuàng)新,、鼓勵藥品優(yōu)先審批審批的政策,,既有綱領性的文件如2018年8月18日《國務院關于改革藥品醫(yī)療器械審評審批制度的意見國發(fā)〔2015〕44號》(俗稱44號文),也具體的政策文件如2017年10月8的中共中央辦公廳,、國務院辦公廳關于《深化審評審批制度改革鼓勵藥品醫(yī)療器械創(chuàng)新的意見》,,亦有配套措施性政策文件如CNDA、衛(wèi)健委聯(lián)合發(fā)文的《關于優(yōu)先藥品注冊審批審批有關事宜的公告(2018年第23號)》,、CNDA的《接受藥品境外臨床試驗數(shù)據(jù)技術指導原則》等,。

注:根據(jù)公開資料整理,供參考,。
*我國新藥上市逐步縮短境內外上市“時差”
過去,,由于種種原因境外新藥在國內上市存在“時差”問題,一些療效顯著的藥品無法及時惠及國內患者,。數(shù)據(jù)顯示,,近十年來,在美國,、歐盟,、日本上市的新藥有415個品種,其中,,有76個已在我國上市,,201個在我國處于臨床試驗或申報階段。
近兩年來,,國家藥監(jiān)部門不斷簡化境外上市新藥審批程序前述提到的多項政策逐步實施,,尤其大力推進有限審評審批對于藥品進口大提速功不可沒。
目前,,優(yōu)先審評審批政策效果已經(jīng)開始顯現(xiàn),,國外新藥上市不斷加速。今年4月到6月短短兩個月內,,九價人乳頭狀瘤病毒(HPV)疫苗,、索磷布韋復方制劑、PD-1抗體藥物納武利尤單抗注射液等7個防治嚴重危及生命疾病的境外新藥,,通過快速審評在我國獲批上市,。這些藥品均為治療腫瘤、丙肝和罕見病的急需藥物,。
附:近三年國內獲批上市的主要新藥清單