2018全年,共有50個醫(yī)療器械獲得創(chuàng)新醫(yī)療器械資格認定并進入特別審批程序,另有19個創(chuàng)新醫(yī)療器械成功獲批上市,;2018全年還有11個醫(yī)療器械被納入醫(yī)療器械優(yōu)先審批程序,,另有3個成功通過優(yōu)先審批程序上市。
新納入50個創(chuàng)新醫(yī)療器械,,19個獲批上市
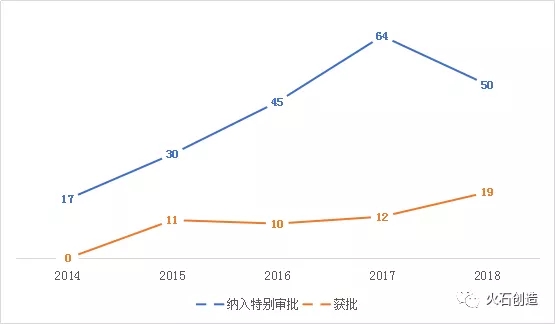
2018年,,醫(yī)療器械技術審評中心(CMDE)一共公示了15批創(chuàng)新醫(yī)療器械特別審批申請審查結果,一共同意將50個申請項目納入創(chuàng)新醫(yī)療器械特別審查程序,,相比2017年的64個,,同比減少了21.9%。同時,,有19個創(chuàng)新醫(yī)療器械產品通過該程序獲批上市,,相比于2017年的12個增加了58.3%。
歷年創(chuàng)新醫(yī)療器械納入審批與獲批數量
數據來源:火石創(chuàng)造整理
注:獲批套件類產品數量按注冊證編號分開統(tǒng)計,,下同
從獲批時間上看,,除2018年略有下降之外,自2014年該程序正式實施以來,,一直保持著穩(wěn)定的增長趨勢,;同時,由于2015年獲批上市的蘇州景昱醫(yī)療器械有限公司研發(fā)的植入式神經刺激系統(tǒng)是由3個套件組成的,,分別擁有3個不同的注冊證編號,,因此實際上歷年獲批數量也是逐年上升的。
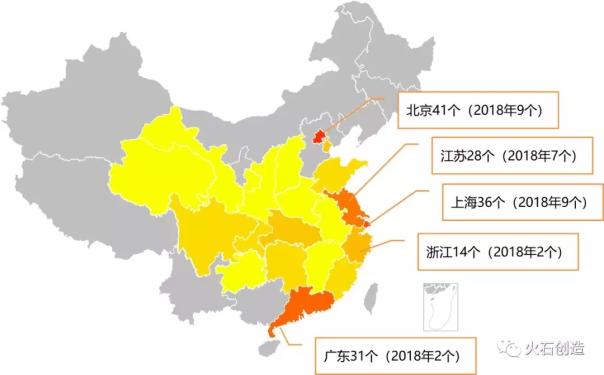
從區(qū)域分布上來看,,除9個進口產品之外,,2018年新納入的41個國產創(chuàng)新醫(yī)療器械主要分布在北京、上海和江蘇,,而在總量上排在第三的廣東省,,2018年僅有2個創(chuàng)新醫(yī)療器械被納入特別審批。
納入創(chuàng)新醫(yī)療器械特別審批產品區(qū)域分布
數據來源:火石創(chuàng)造整理
從產品類型上來看,,植介入產品依然是占比最大的細分類別,,其中又以血管介入類產品為最,僅血管支架就有6個,,包括三個藥物洗脫支架,,創(chuàng)新產品的大量出現從一個側面反映出我國血管支架在全球范圍內處于領先位置這一事實。另外,,體外診斷,、影像設備和治療設備等領域也占據較大比重,在高端醫(yī)療器械國產化替代的不斷推進之下,,我國醫(yī)療器械創(chuàng)新程度不斷提升,。
從申請人來看,,2018年微創(chuàng)醫(yī)療及其旗下子公司共有3個產品被納入,位列第一,,上海聯影,、春立醫(yī)療、湖南埃普特,、全景恒升等也有2個產品被納入,。從歷年總量上來看,微創(chuàng)醫(yī)療集團也以14個的總數量位居第一,。
從獲批產品來看,,廈門艾德生物2018年先后有2個產品通過創(chuàng)新醫(yī)療器械特別審批成功上市,其中“人類10基因突變聯合檢測試劑盒”(維惠健TM)是首個跨癌種的NGS伴隨診斷產品,,也是我國現有獲批NGS產品中獲批基因數目最多,、靈敏度最高的試劑盒,檢測范圍覆蓋了肺癌,、結直腸癌目前已上市的所有靶向藥物需要檢測的基因(EGFR/ ALK/ ROS1/ RET/ KRAS/ NRAS/ PIK3CA/ BRAF/ HER2/ MET),;“人類 EGFR 突變基因檢測試劑盒(多重熒光 PCR 法)”則是我國首個批準用于甲磺酸奧希替尼片的伴隨診斷檢測產品。
醫(yī)療器械優(yōu)先審批新納入11個,,3個獲批上市
醫(yī)療器械優(yōu)先審批程序從2017年1月1日起正式實施,截至2018年底已經有20個產品被納入名單,,包括6個進口醫(yī)療器械和14個國產醫(yī)療器械,。其中,2018年一共有8批共計11個產品被納入醫(yī)療器械優(yōu)先審批名單,,6個進口醫(yī)療器械全部在2018年被納入,。
從同意理由來看,有一半產品因“列入國家重點研發(fā)計劃”而被納入優(yōu)先審批,,數量最多,,其次是“臨床急需,且在我國尚無同品種產品獲準注冊的醫(yī)療器械”,,有7個,。其中,羅氏診斷的“抗PD-L1 (SP142)兔單克隆抗體試劑(免疫組織化學法)”因同時滿足“診斷或者治療惡性腫瘤,,且具有明顯臨床優(yōu)勢”和“臨床急需,,且在我國尚無同品種產品獲準注冊的醫(yī)療器械”而被納入優(yōu)先審批。
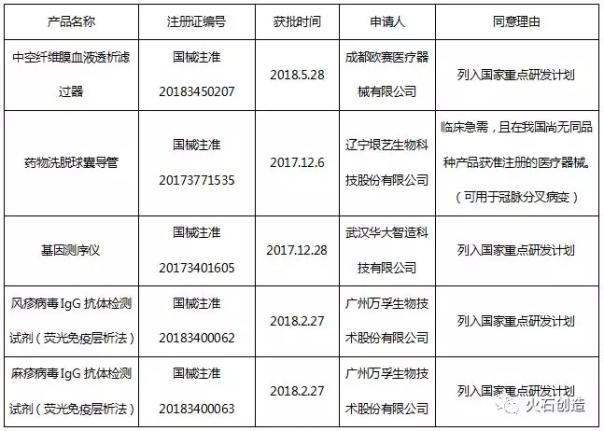
此外,,截至2018年底,,通過優(yōu)先審批上市的醫(yī)療器械共有5個(2017年2個,2018年3個),。
表 通過醫(yī)療器械優(yōu)先審批程序獲批上市的產品清單
數據來源:火石創(chuàng)造整理